这篇也是爷爷为我写的科普文。
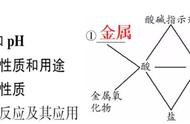
一、物质的化学分类
从化学角度看,物质可分为单质和化合物。由一种元素构成的叫单质,譬如:氧气、汞、金子等。由一种以上元素构成的叫化合物,譬如:二氧化碳、水、二氧化硅等。
化合物又分无机化合物和有机化合物。无机化合物又分几类,主要有氧化物、酸、碱、盐。
二、氧化物
化学性质较活泼的金属或非金属多数可以与氧气反应生成氧化物。
譬如生活最常见的:
C+O2=CO2 (等号上面要加“点燃”两字。)
烧煤做饭菜,或取暖,发生的就是这个化学反应。这是氧与非金属反应。
又譬如:
2Mg+O2=2MgO (等号上面要加“点燃”两字。)
过去拍照,闪光灯不是用电的,是用一些镁粉点燃。镁与氧的反应非常激烈,瞬间就烧完了,发出强光。你去看看老电影就知道了。这是氧与金属反应,生成金属氧化物。
三、酸
某些非金属氧化物跟水反应,会生成酸。譬如,把二氧化碳通入水中生成碳酸。
CO2+H2O=H2CO3
汽水等所谓的碳酸饮料里,就含有大量的碳酸。
酸由酸根和氢离子构成,这也是酸的定义。譬如碳酸,在水中被电离成正氢离子和负碳酸根:
H2CO3=2H +CO3--
所谓氢离子H ,就是氢原子失去它唯一的核外电子变成了正离子。而碳酸根就是原子团(由几个原子组成的复合体)CO3俘获了两个核外电子。
四、碱
某些金属氧化物跟水反应,会生成碱。譬如,
Na2O+H2O=2NaOH
碱由金属离子与氢氧根组成。如NaOH由Na 与OH-组成。
五、盐
酸与碱相遇,多数会发生化学反应,生成物就是盐。譬如盐酸HCl与氢氧化钠反应:
HCl+NaOH=NaCl H2O
生成的就是食盐NaCl和水。酸与碱反应生成盐,这种反应叫中和反应。你自学过的。
水是哪来的?
H +OH-=H2O
就是正的氢离子与负的氢氧根结合变成水分子。
六、PH值
所有的溶液里,都有H⁺和OH⁻。如果氢离子的浓度大于氢氧根的浓度,即[H⁺]>[OH⁻],这溶液是酸性的;如果氢离子的浓度小于氢氧根的浓度,即[H⁺]<[OH⁻],这溶液是碱性的。如果[H⁺]=[OH⁻],就是中性。纯净的水就接近于中性。不同的酸,酸性强弱不同。不同的碱,碱性强弱亦不同。那如何来判断是酸还是碱?是强酸还是弱酸?是强碱还是弱碱?
国际上通行用PH值(也叫酸碱值)来衡量:
PH:=-lg[H⁺]
即,PH值是溶液氢离子浓度的自然对数的相反数。PH值的范围是0~14。最强的酸,PH值是0,最强的碱,PH值是14。中性是7。
上面说的东西,现在不需要全部彻底了解,以后还要深入学习的。你记住粗体字部分就行了。
一个溶液的PH值,理论上说,应该通过化学分析来确定。但是,这样做很麻烦、很费时、很费钱。通常要求不高,我们就用PH试纸来粗略测定。一本PH试纸,里面有许多纸条,和一个比色盘。试纸条浸透了酚酞等四种指示剂。把试纸插入溶液,或在试纸上滴上溶液,就会根据溶液的PH值变色。用它跟比色盘上的色标比较,就可以大概知道溶液的PH值。
爷爷已经买了PH试纸寄给你。你可以试试家里能找到的物质。譬如:米醋、盐水、家里有的几种药水、柠檬、苹果、橘子、梨、牛奶、酸奶、纯碱(俗称碱水)、小苏打、厕所清洁剂、厨房清洁剂、自来水、小区水池的水等等。厕所与厨房这两种清洁剂的PH值,会让你惊讶的。
七、盐的酸碱性
前面说了,酸和碱相遇,会发生中和反应生成盐。那盐的酸碱性呢?都是中性?要看是什么酸跟什么碱反应。
强酸跟强碱反应,生成的盐一般是中性或接近中性的。譬如上面氢氧化钠与氯化氢反应,一个是强碱,一个是强酸,生成的氯化钠(就是我们平时吃的食盐)是中性的。PH值为7。
强酸与弱碱反应,生成强酸弱碱盐,是酸性的。如:
3H2SO4+2Fe(OH)3=Fe2(SO4)3+6H2O
硫酸是典型的强酸H2SO4,氢氧化铁Fe(OH)3是弱碱。反应生成的硫酸铁Fe2(SO4)3就是强酸弱碱盐,呈酸性。
既然有强酸弱碱盐,自然也有弱酸强碱盐。如家里常用的小苏打NaHCO₃,学名是碳酸氢钠。家里常用的还有碱水(也叫纯碱)Na2CO3,学名碳酸钠,也是。都呈碱性。现在我们知道了,纯碱其实不是碱,是一种弱酸强碱盐。它的水溶液呈碱性,人们才称它为纯碱。
因为弱酸强碱盐呈碱性,所以它可以与一些酸反应。譬如做汽水,就是酸性的柠檬水与碱性的小苏打。我们先把柠檬水灌入小口瓶里,然后在可封口的瓶盖里放小苏打。猛的一下把瓶盖扣在瓶子上封死,汽水就制成了。小苏打进入柠檬水后,只要有一点点反应了,就生成二氧化碳。因为有压力,大多数小苏打没法跟柠檬水反应(这个事,以后再详细说。)。当你打开瓶盖时,溶液中的小苏打和柠檬水就立即反应,瞬间生成大量的二氧化碳,把溶液喷了出来。
同样,强酸弱碱盐也因为有酸性,可以与碱或碱性化合物反应。