基本概念
1.关于物理变化与化学变化
核裂变/核聚变不是化学变化(原子是化学变化中的最小单位);
电解质溶液导电是化学变化,金属导电是物理变化;
电离是物理变化;(无新键生成)
原子核外电子跃迁(如焰色反应)是物理变化;
明矾净水是化学变化;
石墨和金刚石转化(白磷变红磷、O2
变O3……)是化学变化;
无水硫酸铜变五水硫酸铜是化学变化;
2.关于纯净物和混合物
胶体、溶液等是“分散系”,“分散系”包括“分散剂”和“分散质”,因
此是混合物;
聚乙烯、聚丙烯等,n值不完全相同,因此是混合物;
合金属于混合物;
一水合氨(NH3·H2O)属于纯净物,但氨水是混合物;
控制CH4:Cl2=1:1,光照下得到的产物是混合物;
3.关于胶体(分散系)
胶体是混合物!(可以是液溶胶、固溶胶、气溶胶)
氢氧化铁胶体的制备:沸水中滴加饱和氯化铁溶液
胶体不能(用滤纸)过滤,但可以用半透膜(渗析)除去
丁达尔效应的描述(答题模板):看到一条光亮的“通路”
4.关于电解质
电解质定义:在水溶液里或熔融状态下能导电的化合物叫做电解质
(教材出处:部编必修一P13、鲁科必修一P53、苏教必修一P20)
电解质/非电解质一定是化合物:Cu是单质,氨水是混合物,故二者既不是电
解质也不是非电解质(但NH3
·H2O是化合物,属于弱电解质)
溶解度和电解质的强弱没有关系:硫酸钡是强电解质
氧化物与电解质:二氧化碳、二氧化硫不是电解质,因为溶于水之后发生反
应才能导电;氧化钠、氧化铝是电解质,因为(属于离子化合物)熔融之后可以导电
酸与电解质:盐酸、硫酸等液态时不导电但是溶于水导电,是(强)电解质;
硫化氢等在水中部分电离,是弱电解质
5.关于物质分类
过氧化钠不是碱性氧化物!(属于过氧化物)
CO既不属于酸性氧化物也不属于碱性氧化物!
NO2虽然能与水反应生成硝酸,但不是酸性氧化物!(经过了氧还)
NaHSO4不是酸!(电离出阳离子不全为氢离子)
6.“反常的”酸
与P有关:
次磷酸H3PO2,是一元酸;
亚磷酸H3PO3,是二元酸;
磷酸H3PO4,是三元酸
与B有关:
硼酸H3BO3,是一元酸,电离方程式H3BO3 H2O=[B(OH)4]- H
7.关于氧化还原(再过一遍基本概念)
氧化剂,得电子,化合价下降,被还原,发生还原反应
还原剂,失电子,化合价上升,被氧化,发生氧化反应
配平注意“2”,如H2C2O4变2CO2,失2电子;
注意同种粒子可能有的参加氧化还原反应,有的没有参加氧化还原反应
8.关于元素的各种概念和参数
,A是质量数,Z是原子序数
质量数和相对原子质量不是一个概念!
质量数是整数(质子数 中子数),没有小数点
“同位素”要求必须质子数相同且中子数不同
同位素必须是核素,如1H和2H是同位素,但1H2
和2H2
不是同位素
问化合价记得标明正负!
9.关于电子式
重点关注:
1. 化学键类型和数目有没有错误(离子键画成共价键、共价键画成离子键)
2. 是否8电子稳定结构
3. 离子记得打括号,标电荷
4. 基团(甲基,…)的电子式有一个单电子
10.共价与离子
AlCl3是共价化合物!
Na2O、Na2O2、Al2O3都是离子化合物!
离子化合物中也可以有共价键:含氧酸盐
也可以有非极性共价键:过氧化钠
11.关于物质的量/气体摩尔体积
溶液中研究粒子物质的量,注意看有没有给定体积;
注意考虑水解或不完全电离;
问几mol化学键,记得把物质展开写(尤其是有机物)
问几mol电子,如果是离子,别忘了要加上/减去所带的电荷
问反应后几mol产物,注意反应是否完全进行(可逆反应?完全燃烧?)
标准状况下1mol气体体积为22.4L
标准状况:0℃,101kPa(不是常温!!)
12.关于溶液的浓度
注意配成溶液之后可能发生的水解或不完全电离:1mol/L碳酸钠溶液中,碳酸根浓度小于1mol/L
溶液的质量分数是溶质质量/溶液质量,如100g质量分数2%的蔗糖溶液中有2g蔗糖98g水
溶解度单位一般是g/100g水,题目给单位时以题目为准
题目给数与22.4有关,先看描述的物质是不是气体
第二节 元素的性质
13.钠的两种氧化物
氧化钠-常温生成-灰白色
过氧化钠-燃烧生成(和水、CO2反应都生成氧气,用于潜艇等)-淡黄色
过氧化钠与水、二氧化碳的反应是Na2O2中氧元素的歧化,一半价下降,一般价上升
例题速览:
(判断)过氧化钠与水反应,生成0.1mol氧气时转移的电子数为0.4NA
答案:错,氧气是从(过氧化钠中的)-1价O来的,而不是水中的-2价O
14.含钠化合物的俗称、性质与用途
NaOH:火碱、烧碱、苛性钠
NaHCO3:小苏打——溶解度小,受热易分解,溶解吸热
Na2CO3:苏打、纯碱——溶解度大,受热不易分解,溶解放热(Na2S2O3:硫代硫酸钠、海波、大苏打)
Na2SO4·10H2O:芒硝
碳酸钠:制肥皂、制玻璃
碳酸氢钠:制药(治疗胃酸过多)、烘焙糕点作膨松剂(鲁科必修一P32-35)
*生理盐水:0.9%氯化钠溶液
*加碘食盐含碘酸钾不含碘单质!
15. 关于焰色反应
用什么工具:铁丝或铂丝
不能用玻璃棒!玻璃中含钠,自己就会产生钠的焰色
*钾的焰色常受钠盐干扰,要透过蓝色钴玻璃观察
16.侯氏制碱法
教材出处:苏教版必修一P73
“制碱”的“碱”指的是纯碱(碳酸钠)
顺序:先通氨气再通二氧化碳
总反应方程式:H2O NH3 CO2 NaCl=NH4Cl NaHCO3↓
之后:NaHCO3
加热分解,终产物是碳酸钠,CO2
循环利用
17.关于氯气参与的反应
和Fe、Cu生成FeCl3、CuCl2
(无论少量过量,注意都是最高价态)
和H2在点燃或光照条件下才反应
氯气与湿润石蕊试纸:先变红,再褪色
18.关于漂白
真正起效的物质是HClO,变质也是通过HClO分解来进行
漂白液:有效成分是NaClO
起效方式:ClO- H2O CO2=HClO HCO3-(注意酸性H2CO3>HClO>HCO3
-)
漂白粉(漂粉精):有效成分是Ca(ClO)2
起效方式:Ca2 2ClO H2O CO2=2HClO CaCO3(碳酸钙是沉淀,因此和漂白液不同)
关于漂白性:
SO2、HClO、H2O2具有漂白性
HClO、H2O2的漂白性是氧化性的体现,SO2
漂白性不是氧化/还原性的体现
能写出具体化学方程式的反应都不体现漂白性
活性炭也可使有色物质褪色,但一般不说具有“漂白性”,原理是吸附(物理变化)
19.铁的氧化物(俗称、反应)
教材出处:部编必修一P67、鲁科必修一P86
FeO——不稳定,受热氧化为Fe3O4
Fe3O4——俗称磁性氧化铁,是磁铁矿主要成分,铁单质在氧气中剧烈燃烧、
与高温水蒸气反应、FeO在空气中受热的产物
Fe2O3——俗称铁红,是赤铁矿主要成分,常用于做红色颜料,是铁在空气中
生锈的最终产物
20.铁的氢氧化物(反应、答题模板)
颜色:氢氧化铁 红褐色;氧化铁 红棕色
现象描述:NaOH溶液滴入FeSO4
溶液中:生成白色沉淀,白色沉淀迅速变为灰绿色,然后变为红褐色
21.关于亚铁/铁离子
检验:
Fe2 :铁氰化钾K3[Fe(CN)6](黄色溶液),生成物是蓝色沉淀KFe[Fe(CN)6](普鲁士蓝)
记得打方括号“[ ]”!
Fe3 :硫氰化钾KSCN(无色溶液),溶液变为红色(不生成沉淀!)
性质:Fe2 还原性强于Br-,故向FeBr2溶液中通少量Cl2会先生成FeBr3
*注意铁氰化钾中铁为 3价,有一定的氧化性,可能对实验有干扰
22. 金属单质与水的反应性
按金属活动性分类:
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
红色:放在液态水里就能反应
蓝色:遇沸水才能反应
绿色:遇高温水蒸气才能反应
黑色:不与水反应
*Zn略有争议
23.铝化合物的转化
Al3 ---Al(OH)3---AlO2-的转化:
铝盐溶液滴加NaOH:先沉淀,后沉淀溶解
铝盐溶液滴加氨水:沉淀,沉淀不溶解
偏铝酸盐溶液滴加HCl:先沉淀,后沉淀溶解
偏铝酸盐溶液通入CO2:沉淀,沉淀不溶解
24.铁、铝与生活
吃:
补铁剂一般是二价铁,补铁剂与维生素C一起服用,因为维生素C具有还原性,
可以避免二价铁被氧化而降低药效;
氢氧化铝可以治疗胃酸过多(和前面提过的碳酸氢钠一样)
用:
制作印刷电路板的原理:镀铜的电路板,把需要保留的电路部分用不透水的
物料覆盖,未覆盖部分被FeCl3溶液腐蚀
红宝石主要成分是氧化铝,红色来源于杂质离子
25.合金
生铁和钢都是铁碳合金,属于混合物;
“硬铝”是一种铝合金
*稀土元素:57-71号元素(镧系元素)和钪、钇,又被称作“冶金工业的维生素”,
我国是稀土资源大国
26.金属的冶炼与获取
按金属活动性分类:
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
红色:电解法,电解熔融盐,不是电解盐溶液
蓝色:热还原法,用H2、CO、C等还原剂
绿色:热分解法,氧化物热稳定性一般,加热分解生成单质和氧气
紫色:物理分离(阳极泥等,但实际上也经常用化学方法),化学性质很不活泼,自然界一般就以单质存在
27.硫单质的反应(与氯气对比,不要搞混!)
与铁单质:生成硫化亚铁FeS,铁为 2价
(氯气生成FeCl3,铁为 3价)
与铜单质:生成硫化亚铜Cu2S,铜为 1价
(氯气生成CuCl2,铜为 2价)
歧化:热碱溶液中歧化生成硫化钠和亚硫酸钠
28.二氧化硫通入钡盐
亚硫酸钡和硫酸钡都是白色沉淀;
二氧化硫通入氯化钡溶液,无沉淀,因为弱酸不能制强酸;
二氧化硫和氨气共同通入氯化钡溶液,有沉淀,因为发生酸碱反应生成大量
亚硫酸根离子;
二氧化硫通入硝酸钡溶液,有沉淀,因为硝酸根有氧化性,生成的是硫酸钡;
二氧化硫通入氯化钡,一段时间有沉淀,因为亚硫酸被氧化为硫酸
29. 接触法制硫酸
原料:硫铁矿FeS2(S是-1价)
先:【沸腾炉】粉碎,高温条件下生成Fe2O3
和SO2
再:【接触室】SO2
在催化剂(V2O5)作用下被O2氧化为SO3
后:【吸收塔】用98.3%的浓硫酸吸收三氧化硫,再稀释成不同浓度的产品
(不用水吸收三氧化硫,是为了防止SO3溶于水时反应放出大量热导致酸雾,降低吸收效率)
30.关于浓硫酸
吸水性是物理变化,脱水性是化学变化;
钝化:铁、铝
浓才钝化,不浓不钝化;
常温钝化,加热仍然会反应;
不是不反应,而是迅速生成致密氧化膜阻碍反应
没有挥发性,但用浓硫酸和亚硫酸钠制备二氧化硫时,气体可能会带出一些浓硫酸小液滴
稀释必须酸入水!
31.浓硫酸与铜的反应
注意要点:
反应结束后体系仍为浓硫酸,生成的硫酸铜是白色固体(无水硫酸铜)
试管内物质倒入水中,变为蓝色;
注意顺序,不可将水倒入试管中,理由和浓硫酸稀释相同
(酸入水,慢搅拌;水入酸,就完蛋)
32.含硫化合物与生活
二氧化硫:可以做食品添加剂,添加到葡萄酒等食品中,抗氧化,但要符合国家标准,不能
超标(苏教必修一P92)
除烟气中二氧化硫:2CaCO3 2SO2 O2=▲=2CaSO4 2CO2
硫酸钙:俗称石膏,生石膏是CaSO4·2H2O,熟石膏是2CaSO4·H2O,用于固定骨折部位等,粉笔主要是石膏
硫酸铜:五水硫酸铜CuSO4·5H2O为蓝色,俗称胆矾或蓝矾,可用于配制农药;
无水硫酸铜为白色,可用于检验水蒸气
硫酸钡:俗称重晶石,不溶于水和酸,不易被X射线穿透,因此硫酸钡悬浊液又称“钡餐”,
用于消化系统X射线检查(苏教必修一P97)
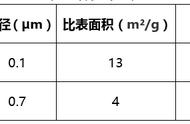
明矾:化学式为KAl(SO4)2·12H2O,用于净水(不是消毒,是水解原理的应用)
绿矾:FeSO4·7H2O
33.关于氨气
液氨可用作制冷剂(汽化大量吸热)
加热NH4Cl固体不能制氨气,因为分解后会立刻重新反应;
合成氨反应ΔH<0,是可逆反应
34.关于硝酸
硝酸盐溶液注意氧化性干扰;
避光保存!
浓硝酸遇Fe、Al钝化,易错点和浓硫酸相同;
35.关于化肥(初中内容)
氮肥:尿素CO(NH2)2
;氨水;碳酸氢铵;氯化铵;硝酸铵;硝酸钠……
磷肥:磷酸钙、磷酸二氢钙……
钾肥:草木灰K2CO3;KCl……
复合肥(含有两种及以上):磷酸二氢铵、磷酸二氢钾、硝酸钾……
主要注意:
铵态氮肥和草木灰/碱性化肥合用降低肥效(双水解)
硝酸铵受热或撞击爆炸(结块不能用锤砸)
36.空气污染、温室效应与酸雨
常见的空气污染物:SO2、NO、NO2、O3、粉尘、一些有机物等等CO2不是空气污染物!(不然植物怎么活呢)
常见的温室气体:CO2、CH4(比CO2
造成温室效应能力还强)
导致酸雨的气体:SO2、NO、NO2、CO2
不导致酸雨!
SO2导致酸雨的过程:SO2 H2O H2SO3 ;2H2SO3 O2=2H2SO4
(二氧化硫-三氧化硫-硫酸比较困难,空气中的二氧
化硫在光照和烟尘中的金属氧化物的作用下“也可”被氧化成三氧化硫)
37.关于消毒/净水
常见消毒剂:
“84”消毒液:NaClO,原理是氧化性使蛋白质变性;
过氧乙酸:CH3COOOH,原理是氧化性使蛋白质变性;
75%医用酒精:CH3CH2OH,原理是蛋白质变性,但不是氧化性!
含碘消毒剂:I2,原理是氧化性使蛋白质变性;
苯酚和甲基(邻、间、对)苯酚都可用于消毒;
甲醛使蛋白质变性,用于防止尸体腐烂,一般不用于消毒
常见净水/水消毒剂:
明矾/三价铁:水解原理,利用胶体的吸附性去除一些悬浮杂质;
臭氧/次氯酸钠/二氧化氯/高铁酸钾(K2FeO4)等:利用氧化性,消毒
39.硅和无机非金属材料
易混内容:
含有硅单质:太阳能电池板、芯片(半导体)
含有二氧化硅:沙子、玻璃、石英、玛瑙、光纤
含有硅酸盐:水泥、陶瓷、黏土
以上都属于无机非金属材料
无机非金属材料还包括新型陶瓷,新型陶瓷一般不是硅酸盐,有碳化硅、氮化硼等等
第三节化学与文化
40.课本上的中国“化学名人”及其事迹
按出生时间:
侯德榜:改善氨碱法,创立侯氏制碱法,联合制取纯碱和氯化铵
吴蕴初:在中国创办第一个氯碱厂、味精厂
张青莲:主持测定了多种元素的相对原子质量新值
屠呦呦:发现青蒿素,用乙醚萃取
41.重要外国化学家及其成就(了解)
人 成就
阿伦尼乌斯 电解质的电离模型
波义耳 石蕊指示剂
舍勒 用MnO2(软锰矿)和浓盐酸首次制出了氯气
门捷列夫 元素周期表、预测了一些元素的存在
哈伯 用N2和H2合成氨
盖斯 盖斯定律(热化学方程式加减)
勒夏特列 勒夏特列原理(平衡移动)
伏打 第一个化学电源
玻尔、泡利、洪特 见后
鲍林 电负性、杂化轨道理论
范德华 范德华力
凯库勒 苯的分子结构(不完全正确,他认为是单双键交替)
42.中国与化学有关的成就
青蒿素:见上
合成结晶牛胰岛素:胰岛素是蛋白质,由两条链通过二硫键连接
可燃冰开采:可燃冰是甲烷水合物,不形成氢键用CO2和H2人工合成淀粉:淀粉是多糖,有助于实现“碳中和”,……
43.碳达峰与碳中和
碳达峰:二氧化碳排放量达到峰值
碳中和:通过植树造林,节能减排等行动抵消生产生活等产生的CO2(不是通过中和反应吸收CO2)
不能“什么都往里装”:燃煤脱硫脱硝跟碳达峰碳中和没关系
第四节 化学反应原理
44.关于反应热
注意正负:吸热反应最好也写一个“+”
注意单位:kJ/mol不要漏
热化学方程式注意标!物!态!
一般认为焓变不随温度改变,催化剂不改变反应焓变!
45.常考反应的焓变正负
合成氨反应:放热,ΔH<0;
二氧化氮→四氧化二氮:放热,ΔH<0
HI分解:吸热,ΔH>0
水的电离:吸热,ΔH>0
盐的水解:吸热,ΔH>0
酸碱中和:放热,ΔH<0
46.关于键能
分子中含有双键、三键时,断掉第一根键(σ键)所需能量最大,即多根键的能量不是平均分配的!
断键吸热,成键放热
47.关于反应速率
计算公式:v=Δc/Δt,几点注意事项:
1. 用浓度计算,c=n/V,注意一些题目是“10L容器”
2. 注意时间单位,是min还是s由题目决定
求得的一般是平均速率;
速率可以以不同的物质为标准,注意物质前系数不同,速率也不同;
影响反应速率的因素:浓度(压强)、温度、催化剂、反应物表面积(研磨)、原电池(搭成原电池之后速率更快)
48.化学平衡:理解与判断
平衡不是“停止反应”,而是正逆反应速率相等,达到动态平衡;
49.化学平衡常数
用浓度:和速率一样,注意“10L容器”这类表述!
看准物态:纯固体纯液体不参与!
记得系数要乘方!
只与温度有关,只要温度不变,无论怎么处理,平衡常数一定不变!
*转化率:反应了多少/起初有多少
50.化学平衡:移动
平衡移动与反应速率:升高温度时,无论平衡怎么移动,正逆反应速率都增大,只是增大幅度不同
读题:注意“恒压”还是“恒容”
例:合成氨体系
恒压充He:体积变大,平衡移动
恒容充He:体积不变,反应物生成物浓度不变,平衡不移动(注意N2有时是惰性气体,有时是反应物)
平衡移动不能抵消条件变化:压缩二氧化氮,颜色加深
51.关于水的离子积常数Kw
25℃时:Kw约为1.0×10-14(是常温,不是标准状态!)
(不要和气体摩尔体积22.4L/mol搞混!)
温度越高,Kw越大,故中性不一定pH=7;
(涉及温度变化的题目别忘了Kw也在变化)
52.关于pH
pH=-lgc(H );(不忘负号,图像题计算注意)
25℃时pH pOH=14;
给pH问H 物质的量时,注意看有没有给定溶液体积;
工业流程题,计算沉淀所需pH时,记得不要写成pOH
pH试纸:常用的广泛pH试纸酸性红色,中性黄色,碱性蓝色
53.关于指示剂
再过一遍颜色和变色范围:
石蕊:变色区间5~8,酸红色碱蓝色
酚酞:变色区间8.2~10,酸无色碱红色
甲基橙:变色区间3.1~4.4,酸红色碱黄色
指示剂是有机弱酸或弱碱,pH不同,结构不同,颜色不同。
54.关于人体中的酸碱平衡(了解)
重点关注:H2CO3/HCO3-离子对在人体中有稳定pH的作用
55.关于水解
本质:阴离子或阳离子与水电离出来的H 或OH-结合,所以水解促进水的电离(酸或碱的电离抑制水的电离),水解产生的H 或OH-本质上是水电离出
来的;
方程式写可逆号,不标沉淀或气体;
越热越水解,越热越电离;越弱越水解,谁强显谁性
56.水解反应的应用
Al3 、Fe3 均可以水解形成胶体,除去水中悬浮物;
原理(答题模板):使水中细小的悬浮颗粒聚集成较大的颗粒而沉降
泡沫灭火器利用了双水解的原理;TiO2
制备利用了水解原理:TiCl4 (x 2)H2O=TiO2
·xH2O 4HCl
57.沉淀溶解平衡
可逆号!
标物态!
看系数!
用Ksp比较溶解度时,要注意化合物“类型”相同
沉淀转化实验时,前一种沉淀剂要过量
58.电化学装置
基本概念不要混:
原电池:化学能变电能
负极失电子发生氧化反应,正极得电子发生还原反应
电解池:电能变化学能
阳极连正极,失电子发生氧化反应;阴极连负极,得电子发生还原反应
离子移动方向:原电池正正负负,电解池阴阳阳阴;
离子迁移数和转移电子数挂钩;
电子不下水,离子不上岸
59.电化学装置中的pH变化
问×极附近:看电极反应式消耗或生成;
问“一段时间后”:看总反应式和离子迁移
60.电解精炼铜
粗铜在阳极,精铜在阴极;
粗铜中铜前金属进入溶液,铜后金属不进入溶液(控制电压),形成阳极泥(含Pt、Au等贵金属)
转移电子数和阳极消耗的精铜数不挂钩
61.金属的腐蚀与防护
吸氧腐蚀和析氢腐蚀都是电化学腐蚀,主要在钢铁(合金)、铁铆钉的铜板(鲁科版教材情
境)等能形成正负极的情境中发生
不论吸氧腐蚀还是吸氢腐蚀,负极反应都是Fe-2e-=Fe2 ;
(电化学腐蚀到 2价, 3价铁的生成和电化学没关系)
教材原文(部编版):实际上,金属腐蚀过程中电化学腐蚀和化学腐蚀往往同时发生,但绝大多数属于电化学腐蚀。电化学腐蚀比化学腐蚀的速率也大得多。
教材原文(鲁科版):在现实生活中,电化学腐蚀现象比化学腐蚀现象更常见。
教材原文(苏教版):电化学腐蚀现象比化学腐蚀现象严重得多……这两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀普遍得多,腐蚀速率也大得多。
牺牲阳极法必须用比Fe活泼的金属,如Zn;
镀层破损也能保护,因为形成了原电池!
外加电流法被保护方连接电源负极!
62. 注意原电池作为影响反应速率的因素出现
注意同一个(氧化还原)反应,做成原电池之后反应速率往往进行得更快,
如:用稀硫酸和锌粒制取氢气,滴加几滴CuSO4
溶液可以加快反应速率
第四节 物质结构与性质
63.能层与能级
概念不弄混:
能层是K、L、M、N、…
能级是1s, 2s, 2p, 3s, 3p, 3d,…
K能层包含1s能级
L能层包含2s、2p能级
M能层包含3s、3p、3d能级 ……
64.能级与原子轨道
能级包含原子轨道,电子在原子核外的一个空间运动状态称为一个原子轨道
1s能级:1s原子轨道(球形)
2s能级:2s原子轨道
2p能级:2px、2py、2pz原子轨道(哑铃形,相互垂直) ……(d、f能级的原子轨道不要求)
65.原子排布遵循的各种原理
把原理名称和内容一一对应:
构造原理:指填入能级的顺序:1s,2s,2p,3s,3p,4s,…(能级交错现象)
泡利原理:一个原子轨道里最多只能容纳两个电子,他们的自旋相反
洪特规则:先单独分占,且自旋平行
能量最低原理:构建基态原子时,电子将尽可能地占据能量最低的原子轨道
66.原子结构的各种“式”
以基态O、Cu原子为例
(核外)电子排布式:O:1s22s22p4;
Cu:1s22s22p63s23p63d104s1
(书写顺序不是构造原理填入的顺序,而是能层和能级的顺序;注意Cr、Cu的特例)
简化的电子排布式:O:[He]2s22p4;
Cu:[Ar]3d104s1
最外层电子的排布式(考察频率较低):O:2s2
2p4;
Cu:4s1;
Cu2 :3d9
(“最外层”指有电子且能量最高的能层)
价(层)电子排布式:O:2s22p4;
Cu:3d104s1
(参与成键的电子,s区写s;p区写s、p;d区和ds区写d和s;p区写s和p。
(书后元素周期表)
66.原子结构的各种“式”
以基态O、Cu原子为例
价(层)电子排布图/轨道表示式:画小方格和箭头;问价层就画价层,没说就全画
注意:自旋;标能级名称
66.原子结构的各种“式”
总结:注意读题!
问什么答什么:价层?最外层?整体?
什么物质:基态原子?离子?
有无特例:Cr、Cu
67.元素周期表的结构和分区
容易忽略:ds区(Cu、Zn)s区不全是金属元素(有H)
族的排列顺序:
IA,IIA,IIIB,IVB,VB,VIB,VIIB,
VIII,IB,IIB,IIIA,IVA,VA,VIA,
VIIA,0

68.第一电离能变化规律与特例
教材出处:部编必修2 P23、鲁科选修2P23-24
特例出现位置与原因:IIA族,VA族,全满/半满稳定

69. 对角线规则
教材出处:部编选修二P22、苏教选修二P43
哪个对角线:左上方-右下方
不是所有的对角线:Li-Mg,Be-Al,B-Si
70.VSEPR:空间结构的标准描述方法
sp杂化:直线形
sp2杂化:平面三角形、V形
sp3杂化:(正)四面体形、三角锥形、V形
注意:是“形”不是“型”;
“正四面体形”和“四面体形”最好区分;
描述用词规范
71.VSEPR:几个概念
中心原子上的价层电子对数:σ键电子对和孤电子对数之和,π键电子对不算
例:CO2中心原子上的价层电子对数:2
孤电子对数:1/2(a-xb),a为中心原子价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数(H为1,其余为8-价电子数)
VSEPR模型:包含孤电子对(与真实结构不同)
教材出处:部编选修2 P49
Sp:直线形;
sp2平面三角形;
sp3:四面体或正四面体
例:NH3
的空间构型:三角锥形
NH3
的VESPR模型:四面体(CH4
的VSEPR模型是正四面体)
72.范德华力与化学键
范德华力不是化学键,是分子间的作用力,比化学键键能弱1-2个数量级;
相对分子质量越大,范德华力越大;
明确范德华力和化学键键能解释问题的区别:
范德华力一般解释物理变化,如分子晶体的熔沸点差异
化学键键能一般解释化学变化,如HF、HCl、HBr、HI的稳定性差异
73.关于氢键
表示:X-H…Y(X、Y为电负性最大的三种元素:N、O、F)
可以不是直线,但为直线时强度最大;
不是化学键!
氢键影响溶解性但不是唯一因素(答题答全)
74.关于晶体
同一种物质,既可以是晶体也可以是非晶体:
如:SiO2
晶体:水晶
非晶体:玻璃、玛瑙
区分晶体与非晶体:教材出处:选择性必修2 P72
一般方法:看有没有固定的熔点
最可靠的方法:X射线衍射实验
75.关于晶胞
必须是平行六面体(三棱柱形状的一定不是晶胞)
必须能够无隙并置(相邻晶胞无空隙无重叠,所有晶胞平行排列,取向相同)
必须是“最小”(一个晶胞不能再拆出若干个符合上面要求的单元)
“数球”:只数平行四面体范围内的
注意顶角的原子不一定是1/8个球(顶角30°),但一个晶胞所有顶角
的原子加起来一定是1个球
76.晶体密度的计算
公式:M/NAV
M: 晶胞内原子的总相对原子质量
V:注意题目所给的晶胞参数是pm还是nm
1pm=10-12m=10-10cm
1nm=10-9m=10-7cm
注意最终密度单位一般是g/cm3
,注意读题
77.晶体类型
分子晶体:所有非金属氢化物、部分非金属单质(卤素、氧、硫、氮、白磷、C60)、部分非
金属氧化物(CO2、SO2、P4O6、……)
特点:低熔点,硬度小
对性质的解释:范德华力(相对分子质量)
共价晶体:某些单质(金刚石、B、Si、Ge)、某些非金属化合物(SiC)
特点:高熔点,硬度大
对性质的解释:共价键的键能(原子半径),如熔点金刚石>SiC>Si
金属晶体:金属单质
特点:延展性、导电性
离子晶体:盐
特点:硬度较大,熔沸点较高
对性质的解释:离子键(但离子晶体也可以有共价键)(电荷多少,原子半径大小)
78.同素异形体的晶体类型
以C为例:
石墨:混合型晶体(层内共价键,层间范德华力)
金刚石:共价晶体
C60:分子晶体
79.关于配合物
课本实验:[Cu(NH3)4]2 配合物的生成CuSO4
溶液中滴加氨水,现象:先生成沉淀,后沉淀溶解
加入乙醇之后析出晶体,原因:乙醇极性较小,溶解度小
配体必须有孤对电子;
配位数关键看提供几对电子,而不是几个配体;
第五节 有机化学基础
80.新教材中官能团的书写规范
请注意与自己使用的教材和所在地区试卷的要求相匹配!
易错字:羰 羟 醛 酮 羧