一 原子的构成
1. 原子结构
原子是由位于原子中心的带正电的原子核和核外带负电的电子构成。原子核是由质子和中子构成的。原子核位于原子的中心,体积很小,原子里有很大的空间,电子在这个空间里做高速运动。

由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
2.构成原子的粒子间的关系
(1)不是所有原子的原子核中都有中子。
(2)核电荷数=质子数=核外电子数。
(3)原子的质子数(或核电荷数)决定原子的种类,因此不同种类的原子,核内质子数不同。
(4)原子核内质子数与中子数不一定相等。
在原子中,原子序数=核电荷数=核内质子数=核外电子数。
在离子中,原子序数=核电荷数=核内质子数
3.核外电子的排布
(1)原子的核外电子排布
①电子层
在含有多个电子的原子里,电子的能量并不相同,能量低的通常在离核较近的区域运动,能量高的通常在离核较远的区域运动。把能量最低、离核最近的叫第一层,能量稍高、离核稍远的叫第二层,由里向外依次类推,叫三、四、五、六、七层。这样的运动,我们称为分层运动或分层排布。现在发现的元素,原子核外电子最少的有1层,最多的有7层。电子层序数越大,层内电子的能量越大,离原子核距离越远。
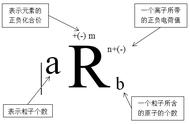
②原子结构示意图:如钠原子结构示意图。

注意:元素的周期数=电子层数,族数=最外层电子书
(2)原子结构示意图的书写规则
要正确书写原子结构示意图,必须遵循核外电子排布的一般规律
①核外电子总是尽先排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层。
② 每个电子层最多能容纳2n2个电子(n为层序数,第一层n=1,第二层n=2)。
③ 最外层电子数不超过8个(第一层为最外层时,不超过2个)。
(3)元素原子最外层电子数与元素化学性质的关系