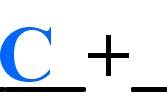1.参加化学反应的各物质的质量总和等于反应后生成的各物质的各物质的质量总和 。这个规律叫做质量守恒定律。一切化学变化都遵循质量守恒定律。
注意:
(1)不能用物理变化来说明质量守恒定律:如2g水加热变成2g水,不能用来说明质量守恒定律;
(2)注意“各物质”的质量总和,不能遗漏任一反应物或生成物;
(3)此定律强调的是质量守恒,不包括体积等其它方面的守恒;
(4)正确理解“参加”的含义,没有参加反应或者反应后剩余物质的质量不要计算在内。

从微观角度分析:化学反应的实质就是反应物的分子分解成原子,原子又重新组合成新的分子,在反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有改变,所以化学反应前后各物质的质量总和必然相等。
化学变化反应前后
五个不变:
(微观)原子的种类不变
原子的数目不变
原子的质量不变
(宏观)元素的种类不变
反应物和生产物总质量不变
两个一定改变:
(宏观)物质种类一定改变
(微观)构成物质的粒子一定改变
一个可能改变:
分子总数可能改变

1.定义:
用化学式来表示化学反应的式子叫做化学方程式。
2.意义:
C O2(点燃)=CO2
表达的意义有哪些?
(1)表示反应物是C和O2;
(2)表示生成物是CO2;
(3)表示反应条件是点燃;
(4)各物质之间的质量比=相对分子量与化学计量数的乘积;
(5)各物质的粒子数量比=化学式前面的化学计量数之比;
(6)气体反应物与气体生产物的体积比=化学计量数之比。
读法:
1.宏观:碳和氧气在点燃的条件下反应生成二氧化碳 ;
2.微观:每 1 个碳原子和 1 个氧分子在点燃的条件下反应生成 1 个二氧化碳分子;
3.质量:每 12 份质量的碳和 32 份质量的氧气在点燃 的条件下反应生成 44份质量的二氧化碳。
各种符号的读法:
“ ”读作“和”或“跟”,“===”读作“反应生产”。