文字表述题规范答题常见模式归纳

Hand with pen drawing the chemical formula of
一、实验部分
1. 检查装置气密性
[答题模板]
装置形成密闭体系→操作造压强差(微热、手捂、热毛巾捂、注水等)→描述现象→得出结论
(1)手捂或热毛巾捂法 将待检装置导气管的一端放入水中,用手或热毛巾捂住装置,若导气管口有气泡逸出,停止加热后在导气管口倒吸形成一段水柱,表明装置气密性良好。
(2)液封法 若是有分液漏斗的装置:用止水夹夹紧导气管的橡皮管,打开分液漏斗玻璃塞往分液漏斗中加水,一段时间后,若漏斗中的水不会再滴下,则装置气密性良好;
启普发生器型(简易)的装置:关闭导气管的旋塞(或用弹簧夹夹住橡胶管),往长颈漏斗中加适量水,若长颈漏斗和容器中液体形成液面差,一段时间后液面差不变,说明装置气密性良好
2. 物质的检验、鉴别
[答题模板]
液体:取少量液体试剂于试管中→滴入XXX试剂→描述现象→得出结论
固体:取少量固体试剂于试管中,加水配成溶液→滴入XXX试剂→描述现象→得出结论
气体:将气体通入XXX溶液中→描述现象→得出结论
3. 测溶液pH的操作:
[答题模板] 取一小块pH试纸放在表面皿上,用(干燥洁净的)玻璃棒蘸取待测液,点在pH试纸中部,待颜色不变,与标准比色卡对照。
4.有机物制备装置中长导管(或冷凝管)的作用:冷凝回流、导气
5.证明沉淀完全的操作:
[答题模板] 静置,取沉淀后的上层清液,再加入××试剂,若没有沉淀生成,说明沉淀完全。
6.洗涤沉淀的操作:
[答题模板] 将蒸馏水沿玻璃棒注入漏斗中至浸没沉淀,静置,待水自然流下,重复操作2~3次(若滤渣易溶于水,可用无水乙醇进行洗涤。可减少沉淀损失,无水乙醇易挥发,不引入杂质。)
7.判断沉淀洗净的方法:
[答题模板] 取最后一次洗涤后的洗涤液,滴加××试剂(可与杂质的某些离子发生沉淀反应),若没有沉淀生成,说明沉淀洗涤干净。
8.焰色反应操作:
用洁净的铂丝(铂丝沾取盐酸)在酒精灯火焰上灼烧,反复几次,直至与酒精灯火焰颜色相近为止。用盐酸洗的原因:金属氯化物的沸点较低,灼烧时挥发除去)沾取少量待测液,在酒精灯火焰上灼烧,观察火焰颜色。若为黄色,则说明溶液中含Na元素;若透过蓝色钴玻璃呈紫色,则说明溶液中含K元素。
9.萃取分液操作:
萃取——关闭分液漏斗的旋塞,打开上口的玻璃塞,将混合物倒入分液漏斗中,盖紧玻璃塞,将分液漏斗倒转过来,充分振荡并不时打开旋塞放气,正立放铁圈上静置 。
分液——将分液漏斗放在铁架台上静置分层,在分液漏斗下面放一个小烧杯,打开上口玻璃塞,旋开旋塞,使下层液体沿烧杯内壁流下。上层液体从上口倒出。
10.滴定终点判断:
[答题模板] 当滴入最后一滴液体时,溶液由__色变为__色,且半分钟内不发生变化。(如果最后有色,通常要保证半分钟内颜色不发生变化;如果最后为无色,通常要求半分钟内不恢复为原来颜色)。
滴定操作:滴定时,左手控制滴定管活塞,右手振荡锥形瓶,眼睛注视锥形瓶内溶液颜色的变化。
11.浓硫酸稀释(或与其它液体混合)操作:
[答题模板] 将浓硫酸沿烧杯内壁缓缓注入水(无水乙醇、浓硝酸、乙酸等),并不断搅拌。
12.沉淀醇洗(冰水)的目的[对在水中溶解度较大的固体,过滤后要用乙醇(冰水)洗涤]:
原因: [答题模板] (1)固体在乙醇溶解度较小;(2)除去固体表面吸附的杂质;
(3)乙醇挥发带出水分,使固体易干燥
13 滴定管的润洗
润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次
14 仪器的检漏
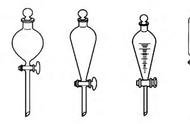
①分液漏斗检漏:
关闭分液漏斗颈部旋塞,向分液漏斗内注入适量的蒸馏水,观察旋塞的两端以及漏斗的下口处是否漏水,若不漏水,关闭上磨口塞,左手握住旋塞,右手食指摁住上磨口塞,倒立,检查是否漏水;若不漏水,正立,将上磨口塞旋转180度,倒立,检查是否漏水,若不漏水,则此分液漏斗可以使用.
②容量瓶检漏:
往容量瓶中加入一定量水,塞好玻璃塞, 用食指按住塞子,另一只手托住瓶底,倒立,观察塞子周围是否漏水; 若不漏水,正立后将玻璃塞旋转180°后塞紧,倒立,再检查是否漏水。
③酸式滴定管检漏
先关闭活塞,装水至“0”线以上,直立约2 min,仔细观察有无水滴滴下,然后将活塞转180°,再直立2 min,观察有无水滴滴下.
15.固液加热型制气装置中滴液漏斗与圆底烧瓶之间导管的作用:
[答题模板] 平衡气压,使分液漏斗中的液体易于滴下。
16.装置的安装与连接:
自下而上,从左到右;洗气瓶“长进短出”,净化装置先除杂后干燥;干燥管“粗进细出”;排水量气的“洗气瓶”气体流向“短进长出”;蒸馏或冷却装置中的冷凝管冷却水的流向“低进高出”。
17.蒸发结晶操作:
[答题模板] 将溶液转移到蒸发皿中加热,并用玻璃棒搅拌,待有大量晶体出现时停止加热,利用余热蒸干剩余水分 。
18.排水量气读取体积的要求:
(1)冷却至室温;(2)两液面相平;(3) 读数时,视线与凹液面最低点相切
另:实验前广口瓶与量筒间的导管中应充满水
19.过滤的方式?降温结晶主要包括哪些步骤?
过滤、趁热过滤;蒸发浓缩、冷却结晶、过滤、洗涤、干燥。

二、化学工艺流程题常考查
1、对反应条件的分析可从以下几个方面着手:
A、对反应速率有何影响? (如何提高浸出率?如何提高反应速率?)
B、对平衡转化率、产率有何影响?(如何提高产率?)
运用勒夏特列原理解释(其它条件不变情况下,改变××条件,可逆反应:。。。。。。,平衡向×方向移动,导致××发生变化
C、对综合生产效益有何影响?(如原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护)——从绿色化学方面作答。
2、对流程理解的问题:
A、滤渣、滤液的主要成分?(明确发生了什么反应)
B、该反应的化学方程式?
C、循环利用与回收利用的物质?(循环利用是作为原料投入了,却没有消耗或没有消耗完;回收利用是指副产品)
D、特定步骤中加某物质的作用?(一般题干会有隐含信息。比如加NaCl可以提高PbCl2的溶解度,加NaCl可以降低过碳酸钠的溶解度等等)
3、高频问题:
①“浸出”步骤中,为提高镁的浸出率,可采取的措施有:
答:适当提高反应温度、增加浸出时间,加入过量硫酸,边加硫酸边搅拌
②如何提高吸收液和SO2反应速率:
答:适当提高温度、增大吸收液的浓度、增大SO2与吸收液的接触面积或搅拌
③从溶液中得到晶体:
答:蒸发浓缩-冷却结晶-过滤-洗涤-干燥
④过滤用到的三个玻璃仪器:
答:普通漏斗、玻璃棒、烧杯
⑤过滤后滤液仍然浑浊的可能的操作原因:
答:玻璃棒下端靠在滤纸的单层处,导致滤纸破损;漏斗中液面高于滤纸边缘
⑥沉淀洗涤操作:
答:往漏斗中(工业上改为往过滤器中)加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2-3次
⑦检验沉淀Fe(OH)3是否洗涤干净(含SO42-):
答:取最后一次洗涤液,加入BaCl2溶液,若有白色沉淀则说明未洗涤干净,反之则洗涤干净
⑧如何从MgCl2·6H2O中得到无水MgCl2:
答:在干燥的HCl气流中加热,干燥的HCl气流中抑制了MgCl2的水解,且带走MgCl2·6H2O受热产生的水汽
⑨直接加热MgCl2·6H2O易得到Mg(OH)Cl的方程式:
⑩CuCl2中混有Fe3 加何种试剂调pH值:
答:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3。原因:加CuO消耗溶液中的H 的,促进Fe3 的水解,生成Fe(OH)3沉淀析出
(11)、调pH值使得Cu2 (4.7-6.2)中的Fe3 (2.1~3.2)沉淀,pH值范围是:
答:3.2~4.7。原因:调节溶液的pH值至3.2~4.7,使Fe3 全部以Fe(OH)3沉淀的形式析出而Cu2 不沉淀,且不会引入新杂质
(12)、产品进一步提纯的操作:答:重结晶
(13)、趁热过滤的原因即操作:
答:减少过滤时间、保持过滤温度,防止××杂质析出;操作:已预热的布氏漏斗趁热抽滤
(14)、水浴加热的好处:
答:受热均匀,温度可控,且温度不超过100℃
(15)、减压蒸发(小心烘干):
答:常压蒸发温度过高,××易分解;或者减压蒸发降低了蒸发温度,可以防止××分解
(16)、Mg(OH)2沉淀中混有Ca(OH)2应怎样除去:
答:加入MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水水洗涤
(17)、蒸发浓缩用到的主要仪器有 、 、烧杯、酒精灯等
答:蒸发皿、玻璃棒。还有取蒸发皿用坩埚钳
(18)、不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是:
答:加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净
(19)、检验NH4+的方法是:
答:取××少许,加入NaOH溶液后加热,生成的气体能使润湿的红色石蕊试纸变蓝。(注意方法与操作的差别)
(20)、过滤的沉淀欲称重之前的操作:
答:过滤,洗涤,干燥,(在干燥器中)冷却,称重

(21)、“趁热过滤”后,有时先往滤液中加入少量水,加热至沸,然后再“冷却结晶”:
答:稀释溶液,防止降温过程中××析出,提高产品的纯度
(22)、苯甲酸的重结晶中粗苯甲酸全部溶解后,再加入少量蒸馏水的目的:
答:为了减少趁热过滤过程中损失苯甲酸,一般再加入少量蒸馏水
(23)、加NaCl固体减低了过碳酸钠的溶解度,原因:
答:Na 浓度显著增加抑止了过碳酸钠的溶解
(24)、检验Fe(OH)3是否沉淀完全的试验操作是:
答:取少量上层清液或过滤后的滤液,滴加几滴KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全。/
(25)、检验滤液中是否含有Fe3 的操作是:
滴入少量KSCN溶液,若出现血红色,则证明有Fe3 )(或加NaOH,根据情况而定)
,