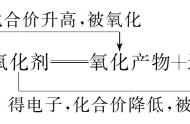
5、勒夏特列原理
定义:如果改变影响平衡的一个条件(如C、P或T等),平衡就向能够减弱这种改变的方向移动。
原理适用的范围:已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:外界条件改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:外界因素对平衡体系的影响占主要方面。
第三章 水溶液中的离子平衡
一、弱电解质的电离
1、定义:电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
非电解质:在水溶液中或熔化状态下都不能导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。

2、电解质与非电解质本质区别:
电解质——离子化合物或共价化合物 非电解质——共价化合物
注意:①电解质、非电解质都是化合物 ②SO2、NH3、CO2等属于非电解质
③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4 为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质分子电离成 离子的速率 和离子结合成 时,电离过程就达到了 平衡状态 ,这叫电离平衡。
4、影响电离平衡的因素:
A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
5、电离方程式的书写:用可逆符号 弱酸的电离要分布写(第一步为主)
6、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。)

表示方法:ABA B- Ki=[ A ][B-]/[AB]
7、影响因素:
a、电离常数的大小主要由物质的本性决定。
b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。
C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO
二、水的电离和溶液的酸碱性
1、水电离平衡:

水的离子积:KW= c[H ]·c[OH-]
25℃时,[H ]=[OH-] =10-7 mol/L ; KW= [H ]·[OH-] = 1*10-14
注意:KW只与温度有关,温度一定,则KW值一定
KW不仅适用于纯水,适用于任何溶液(酸、碱、盐)
2、水电离特点:(1)可逆(2)吸热(3)极弱
3、影响水电离平衡的外界因素:
①酸、碱:抑制水的电离 KW〈1*10-14
②温度:促进水的电离(水的电离是 吸 热的)
③易水解的盐:促进水的电离 KW 〉1*10-14
4、溶液的酸碱性和pH:
(1)pH=-lgc[H ]
(2)pH的测定方法:
酸碱指示剂—— 甲基橙 、石蕊 、酚酞 。
变色范围:甲基橙3.1~4.4(橙色) 石蕊5.0~8.0(紫色) 酚酞8.2~10.0(浅红色)
pH试纸—操作 玻璃棒蘸取未知液体在试纸上,然后与标准比色卡对比即可 。
注意:①事先不能用水湿润PH试纸;②广泛pH试纸只能读取整数值或范围
三、混合液的pH值计算方法公式
1、强酸与强酸的混合:(先求[H ]混:将两种酸中的H 离子物质的量相加除以总体积,再求其它) [H ]混=([H ]1V1 [H ]2V2)/(V1 V2)
2、强碱与强碱的混合:(先求[OH-]混:将两种酸中的OH‑离子物质的量相加除以总体积,再求其它) [OH-]混=([OH-]1V1 [OH-]2V2)/(V1 V2) (注意:不能直接计算[H ]混)
3、强酸与强碱的混合:(先据H OH-==H2O计算余下的H 或OH-,①H 有余,则用余下的H 数除以溶液总体积求[H ]混;OH-有余,则用余下的OH-数除以溶液总体积求[OH-]混,再求其它)
四、稀释过程溶液pH值的变化规律:
1、强酸溶液:稀释10n倍时,pH稀=pH原 n (但始终不能大于或等于7)
2、弱酸溶液:稀释10n倍时,pH稀〈pH原 n (但始终不能大于或等于7)
3、强碱溶液:稀释10n倍时,pH稀=pH原-n (但始终不能小于或等于7)
4、弱碱溶液:稀释10n倍时,pH稀〉pH原-n (但始终不能小于或等于7)
5、不论任何溶液,稀释时pH均是向7靠近(即向中性靠近);任何溶液无限稀释后pH均接近7
6、稀释时,弱酸、弱碱和水解的盐溶液的pH变化得慢,强酸、强碱变化得快。
五、强酸(pH1)强碱(pH2)混和计算规律w
.w.w.k.s.5.u.c.o.m
1、若等体积混合
pH1 pH2=14 则溶液显中性pH=7
pH1 pH2≥15 则溶液显碱性pH=pH2-0.3
pH1 pH2≤13 则溶液显酸性pH=pH1 0.3
2、若混合后显中性
pH1 pH2=14 V酸:V碱=1:1
pH1 pH2≠14 V酸:V碱=1:10〔14-(pH1 pH2)〕
六、酸碱中和滴定:
1、中和滴定的原理
实质:H OH—=H2O 即酸能提供的H 和碱能提供的OH-物质的量相等。
2、中和滴定的操作过程:
(1)仪②滴定管的刻度,O刻度在上 ,往下刻度标数越来越大,全部容积 大于 它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度,不得一次滴定使用两滴定管酸(或碱),也不得中途向滴定管中添加。②滴定管可以读到小数点后 一位 。
(2)药品:标准液;待测液;指示剂。
(3)准备过程:
准备:检漏、洗涤、润洗、装液、赶气泡、调液面。(洗涤:用洗液洗→检漏:滴定管是否漏水→用水洗→用标准液洗(或待测液洗)→装溶液→排气泡→调液面→记数据V(始)
(4)试验过程
3、酸碱中和滴定的误差分析
误差分析:利用n酸c酸V酸=n碱c碱V碱进行分析
式中:n——酸或碱中氢原子或氢氧根离子数;c——酸或碱的物质的量浓度;
V——酸或碱溶液的体积。当用酸去滴定碱确定碱的浓度时,则:
c碱=