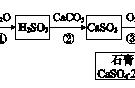
⒈ 化学方法除杂的要求
⑴ 操作方法简便易行。
⑵ 加入的试剂只与杂质反应,不与原物反应。
⑶ 除杂试剂须过量,以保证杂质除净。
⑷ 过量试剂须除尽,以确保不引入新的杂质。
⑸ 反应后不能带入新的杂质。
⑹ 反应后恢复原物状态。
⑺ 除杂途径须最佳,除去多种杂质时要考虑加入试剂的先后顺序。在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去。
⒉ 无机物除杂的方法实例:
⑴ 生成沉淀法:在混合物中加入某种试剂,使其中一种生成沉淀通过过滤而除去,以沉淀的形式分离出去的方法。
例如NaCl溶液里混有少量的MgCl2杂质,可加入过量的NaOH溶液,使Mg2 离子转化为Mg(OH)2沉淀(但引入新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。MgCl2 2NaOH=Mg(OH)2 2NaCl
如除去氯化钠中的硫酸镁:把混合物溶于水,得到含Na ,Cl-,Mg2 ,SO42-的溶液。其中杂质为Mg2 和SO42-,据此要求所加入的试剂的阳离子能与SO42-形成沉淀,加入试剂的阴离子能与Mg2 形成沉淀。故可向溶液中逐滴加入Ba(OH)2溶液至不再产生沉淀为止,过滤、蒸发滤液即得纯净的氯化钠。
MgSO4 Ba(OH)2=BaSO4↓ Mg(OH)2
⑵ 生成气体法:采用加热或加入某种试剂,使杂质转变为气体(通常为稀盐酸和稀硫酸)。例如Na2SO4溶液中混有少量Na2CO3,为了不引入新的杂质并增加SO42-,可加入适量的稀H2SO4,将CO32-转化为CO2气体而除去。Na2CO3 H2SO4=Na2SO4 CO2↑ H2O
再如除去氯化钠中的碳酸钠:把混合物溶于水,得到含Na ,Cl-,CO32-的溶液,其中杂质为CO32-。CO32-可通过加入适量盐酸转变为CO2除去(当然也可以使CO32-转化为沉淀除去),然后将溶液蒸干即得纯净的氯化钠。
Na2CO3 2HCl=2NaCl CO2↑ H2O
⑶ 酸碱溶解法:利用物质与酸或碱溶液混合后反应的差异,用酸或碱溶液把杂质转变成液体而除去。如Cu粉中含有少量的Fe粉,可用稀硫酸或稀盐酸除去。
Fe 2HCl=FeCl2 H2↑
如用过量的NaOH溶液可除去Fe2O3中的Al2O3
Al2O3 2NaOH=2NaAlO2 H2O
⑷ 氧化还原法:用氧化剂(还原剂)除去具有还原性(或氧化性)的杂质例如在FeCl3溶液里含有少量FeCl2杂质,可通入适量的Cl2气将FeCl2氧化为FeCl3。若在FeCl2溶液里含有少量FeCl3,可加入适量的铁粉而将其除去。
2FeCl2 Cl2=2FeCl3
⑸ 正盐和与酸式盐相互转化法:例如NaHCO3溶液中混有少量Na2CO3杂质,可向溶液里通入足量CO2,使Na2CO3转化为NaHCO3。
Na2CO3 CO2 H2O=2NaHCO3
⑹ 转换法:通过反应将杂质转变为被提纯的物质。如欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为酚钠,利用苯酚钠易溶于水,使之与苯分开。
欲除去HNO3中混有的少量H2SO4,可加适量的Ba(NO3)2除去。
H2SO 4Ba(NO3)2=BaSO4↓ 2HNO3
除去二氧化碳气体中的一氧化碳气体:把混合气体通过灼热氧化铜充分发生反应,即可把一氧化碳转变为二氧化碳而除去。
CO CuO=(灼烧)CO2 Cu
⑺ 置换法:将混合物中的杂质与适量试剂通过发生置换反应而除去。常用活泼金属置换盐中的不活泼金属,达到除去杂质的目的。
如除去硫酸亚铁中的硫酸铜:把混合物溶于水,得到含Cu2 ,Fe2 ,SO42-的溶液,其中杂质为Cu2 。向混合溶液中加入过量铁粉,铁粉与Cu2 发生置换反应,然后过滤、蒸发结晶即得纯净的硫酸亚铁。Fe CuSO4=FeSO4 Cu。
如:硫酸锌固体中含有少量硫酸铜杂质,可将混合物溶解之后,加入适量锌粉,再过滤除去被置换出来的铜,蒸发滤液获得硫酸铜固体。
Zn CuSO4=ZnSO4 Cu。
⑻ 吸收法:两种以上混合气体中的杂质被某种溶剂或溶液吸收, 而要提纯的气体不能被吸收时,可用此方法。常用来除去气体中的杂质。选择适当的试剂与气体中的杂质反应即可达到目的。一般地,酸性气体用碱溶液吸收;碱性气体用酸溶液吸收;如CO中混有少量CO2时,可将混合气体通过盛有氢氧化钠的溶液来除去。
CO2 2NaOH=Na2CO3 H2O
欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠的溶液后,再通过浓硫酸。
NaCO3 2HCl=2NaCl CO2↑ H2O
O2一般用灼热铜网吸收等。
O2 2Cu=(灼烧)2CuO
⑼ 利用物质的两性除去杂质:例如在Fe2O3里混有少量的Al2O3杂质,可利用Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的NaOH溶液,使其中Al2O3转化为可溶性NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3。

Al2O3 2NaOH=2NaAlO2 H2O
NaAlO2 2H2O CO2=Al(OH)3↓ NaHCO3
2Al(OH)3=(灼烧)Al2O3 3H2O
⑽ 热分解法:通过加热(高温)将不稳定的杂质转变为被提纯的物质。此法是利用混和物中各组分热稳定性不同,将其进行加热或灼烧处理,从而分离物质。如:Na2CO3固体中含有少量NaHCO3杂质,可将固体加热,使NaHCO3分解生成Na2CO3,而除去杂质。氧化钙中含有碳酸钙,可采用高温燃烧的方法,使碳酸钙高温分解成氧化钙和二氧化碳,二氧化碳扩散到空气中,除去杂质。
2NaHCO3=(高温)Na2CO3 CO2↑ H2O
⑾ 络合法:利用组分中某一成分可以形成络合物的性质来分离提纯物质。如:分离Al2O3和ZnO的混和物:

Al2O3 6HCl=2AlCl3 3H2O
AlCl3 3NH3.H2O=Al(OH)3↓ 3NH4Cl
2Al(OH)3=(∆)Al2O3 3H2O
ZnO 2HCl=ZnCl2 H2O
ZnCl2 4NH3.H2O=Zn(NH3)4Cl2 4H2O
Zn(NH3)4Cl2 4HCl=ZnCl2 4NH4Cl
ZnCl2 2NH3.H2O=Zn(OH)2↓ 2NH4Cl
Zn(OH)2=(灼烧)ZnO H2O
⑿ 电解法:利用电解的原理来分离提纯物质。如:电解精炼铜。
⒀ 离子交换法:例如用磺化煤(NaR)做阳离子交换剂,与硬水里的Ca2 、Mg2 进行交换,而使硬水软化。
⒁ 调节溶液pH法 加入试剂来调节溶液的pH,使溶液中的某些成分沉淀而分离除去。
⒂ 综合法:欲除去某物质中的杂质,可采用以上各种方法或多种方法综合运用。