1 概述
亚硫酸钠属于无机盐工业中较成熟的无机化工产品,在众多行业中被广泛应用: 印染工业作为脱氧剂和漂白剂; 感光工业用作显影剂; 有机化工工业用作还原剂; 食品工业用作防腐剂和疏松剂; 无机化工工业用作还原剂; 造纸工业用作木质煮脱除剂,另外在电子行业,电镀行业,香料工业也有应用。传统的亚硫酸钠的工业生产方法主要采用纯碱吸收二氧化
硫法,冷结晶法等方法。近年来,随着纯碱资源的紧张,生产成本上扬,使许多生产企业无利可图,厂家经济效益不高。
新方法采用 SO2,NH3和 NaCl 为原料生产无水亚硫酸钠,原料不但价廉易得,而且综合利用好,特别适合有 SO2排出的企业。这样大大降低了生产成本,减少了设备投资。同时副产品氯化铵又可以直接用于农用高效复合肥。在精制实验中,现在应用比较广泛的是重结晶法,即将粗亚硫酸钠加水溶解,过滤,除去机械杂质,再将蒸发至一定浓度进行浓缩
结晶,过滤,热水洗涤,干燥,即得成品。
2 制备原理
由 SO2,NH3和 NaCl 为原料生产无水亚硫酸钠是基于下述反应:
S O ==2SO2
2NH3 SO2 H2O==( NH4)2SO3
( NH4)2SO3 2NaCl==Na2SO3 2NH4Cl
60 ℃~80 ℃ 时 2Na ,2NH4 ∥SO32- ,2Cl-四元体系中的平衡趋向于亚硫酸钠占有最大的结晶区。所以,当向热的亚硫酸氨溶液中加入细的氯化钠结晶时,氯化钠能大量溶解而沉淀出无水亚硫酸钠。分离沉淀后溶液中剩下的是氯化铵。溶液用二氧化硫气体饱和,使剩余的亚硫酸盐转变亚硫酸氢盐,并将溶液冷却到 25 ℃,氯化铵即行结晶。此时该体系转变为 Na ,NH4 ∥HSO-3,Cl-,此时氯化铵结晶区扩大。这就有可能选择适宜的溶液浓度,使氯化铵结晶析出。剩下的溶液含有一些氯化铵和亚硫酸氢钠; 用氨饱和,亚硫酸氢盐重新转变成亚硫酸盐。将溶液加热,再用食盐处理,如此反复进行。这样,就可以制取亚硫酸钠和氯化铵。
3 工艺流程
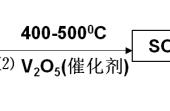
3.1 制备工艺( 图 1)
图 1 重结晶制取亚硫酸钠
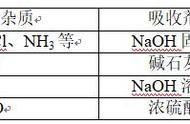
3.2 精制工艺( 图 2)
图 2 亚硫酸钠精制工艺简图
4 实验步骤
( 1) 配制母液
加热亚硫酸,将二氧化硫通入 14. 8% 氨水中。
2NH3 SO2 H2O====( NH4)2SO3
( 2) 沉淀 Na2SO3
将起始溶液 l( 含 SO32-) 加入反应器 1,升温至60 ℃ 以上,在不断搅拌下加入 NaCl 细晶,NaCl 溶解,Na2SO3沉淀析出,反应式为:
2NaCl SO32-====3Na2SO3 2Cl- ( 1)
第一次反应需要的溶液 1 由配制而得。以后则为循环液。
( 3) 分离、干燥 Na2SO3
将上述含 Na2SO3沉淀物的料浆用真空装置抽滤,进行固液分离。固体经干燥得 Na2SO3产品。剩下溶液 2。
( 4) 将 SO32- -3转变成 HSO3-
往反应器 2 中加溶液 2,通 SO2使 SO32-转变成HSO3-,制得溶液 3。反应式为:
SO32- SO2 H2O====HSO3- ( 2)
( 5) NH4Cl 结晶、分离
将溶液 3 冷却至 25 ℃,析出 NH4Cl 结晶。料浆用真空抽滤装置进行固液分离,制得 NH4CI 副产品。剩下溶液 4。
( 6) 制备溶液 1
往反应器 3 中加溶液 4,通 NH3制得溶液 1,送往反应器 1。反应式为:
HSO3- NH3====3NH4- SO32- ( 3)
至此已完成一个循环。可见整个循环由三个反应、一个结晶、二个固液分离和一个干燥过程组成。
( 7) 精制 Na2SO3
将粗亚硫酸钠在搅拌下加水溶解,根据亚硫酸钠在水中的溶解度,控制溶解温度为 35 ℃左右,用水量为粗亚硫酸钠重量的 3 倍 ~4 倍。溶解后的溶液是黄棕色透明液体,若溶液浑浊,说明未完全溶解。可适当补充水,使其完全溶解。然后过滤,除去水不溶物,得到浅黄色的滤液。在搅拌下以电炉加热进行蒸发,随着蒸发的进行,溶液中不断有晶体析出,当达到预蒸发终点时,停止加热,趁热过滤,用回料量 10% ~ 20% 热水洗涤晶体,在 120 ℃下干燥,即得产品。
5 实验条件
( 1) 溶液组成
溶液 1: NH 4,10% ~ 11% ; SO2 -3,17% ~ 18% ;
组成: 310 m L,H2SO3; 27. 2 g,H2O; 39. 5g,NH3。
( 2) 反应结晶温度
反应( 1) 在 60 ℃ ~ 90 ℃ 范围内进行。此时的物料点在亚硫酸钠的结晶区,能使氯化钠更充分的溶解,析出更多的亚硫酸钠。反应( 2) ,( 3) 在 40 ℃~ 70℃ 范围内进行,温度不宜太高,既需防止二氧化硫、氨气的逸出,也要使反应充分进行,而且温度过
高会使氯化铵分解。
根据对两个四元体系相图的分析,氯化铵的结晶温度应控制在 25℃ 为宜,而亚硫酸钠在 85℃ 时,饱和结晶区最大,此温度下分离效果最好。
在重结晶实验中,要控制溶解用的水量,水量过少使溶解不完全,而水量过大则增大蒸发负荷,所以溶液的比重控制在 1. 15 ~ 1. 20 为宜,而溶液的 p H值则宜在 10 ~ 12。
6 实验结果及分析
6.1 产品质量
主产品 60.01 g,副产品 50.18 g。经计算含量得:
Na2SO3% = 57.91 /60.01 × 100% = 96.5%
NH4Cl% = 46.67 /50.18 × 100% = 93.0%
所得无水亚硫酸钠符合 GB9005 -88 一级工业品质量要求,所得 NH4Cl 副产品含量 93% ,同样符合国标要求,可作为农业肥料,也可加工成工业氯化铵。
6.2 原料利用率
每制 100 g 无水亚硫酸钠,各种物料以消耗量及副产品物量如表 1。
表 1 无水亚硫酸钠原料消耗( 以 100 g 计)
原料 |
理论值 /g |
实际值 /g |
利用率 /% |
SO2 |
50.79 |
54.4 |
93.36 |
NH3 |
26.98 |
30.5 |
88.5 |
Na Cl |
92.00 |
101.0 |
91.09 |
副产品 NH4Cl |
85.00 |
87.1 |
实验结果表明,产品质量可达国标要求。而原料消耗高于理论值,其中氨的利用率较低,主要是溶液 1 中含少量游离氨。在反应过程中游离氨被挥发掉。NH4Cl 高于理论值是因含水和杂质。
6.3 成本对比
无水亚硫酸钠原料成本对比:
碱法 1( 以硫磺、纯碱、烧碱为原料) 成本合计:2 104 元 / t;
碱法 2( 以硫磺、纯碱为原料) 成本合计:2 096 元 / t;
氨盐法( 以硫磺、液氨、工业盐为原料,副产氯化铵) 成本合计: 753 元/t。
6.4 实验现象
( 1) 将 SO2通入 NH4·H2O 时,反应器壁发热。检查其他管路并无发热现象。说明这是反应热,更说明此反应为放热反应。
( 2) 将 SO2通入 NH3·H2O 时,大约 20 min 后,NH3·H2O 上方出现白雾,原因是 SO2来不及与NH3反应,同时冒出所致。因此在实际生产中这一反应管上方应密闭,避免造成损失。
(3) 溶液中加入Na Cl 时的温度应控制在60℃,而且应不断搅拌,防止包夹现象产生,从而可以提高产品质量。
( 4) SO2蒸发时,需经过冷凝装置才能通入 NH3·H2O 中,为了防止倒吸现象。
6 结论
用 SO2,NH3和 NaCl 制取无水亚硫酸钠,其成本会比碱法低很多。通过原料成本对比氨盐法原料成本比碱法成本要低 1 100 元/t 以上。成本低的原因是原料综合利用率好,原料廉价。
此法特别适用于有废 SO2排出,需要进行处理的厂家,该法也适用于合成氨厂,因液氨是产品,硫磺是副产品,原料价格便宜。
用 SO2、NH3和 NaCl 制无水亚硫酸钠具有原料价廉易得,原料综合利用好,能副产氯化铵,无废料排出等优点,用于回收排放废气中的 SO2具有良好的经济效益和社会效益,应用前景广阔.