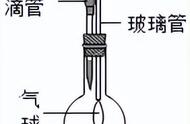
除了吸热反应、放热反应这一个条件之外,教材为我们介绍了一个新的概念,也是一个物理量,它叫做熵。比如在密闭的一种条件下,体系从有序的、自发的转变成无序的,这样的倾向我们可以用熵去衡量,就是混乱程度。混乱程度用s去表示,也就是熵低代表很整齐,混乱度很小,而熵高代表很混乱,从熵低变熵高的过程,△S会大于零。

我们会观察到无论是水自发的进行,还是放热反应或吸热反应,这些都是自发的从混乱度小、有序的状态变成混乱度大、无序的状态进行的。

那我们再以一些化学方程式为例来解释熵增的过程。比如这里面方程式展示到的锌是固态、硫酸是液态、硫酸锌是液态、氢气是气态、氯酸钾是固态,氯化钾是固态,而氧气是气态。所谓的熵增就是混乱度,它会越来变得越大。但是有些熵减的过程也是自发的,比如乙烯聚合成聚乙烯的过程,虽然混乱度在减小,但是它可以自发的进行。而且屏幕上方展示的这两个方程式虽然也在熵减,但是都是可以自发进行的。
最熟悉的就是氢氧化铁变成氢氧化亚铁的过程,这是一个明显的熵减过程,可是它可以自发地进行。由此我们得到的这样的结论,不能只根据熵增或熵减来判断化学反应进行的方向。

上面的内容总结下来,我们会观察到自发反应的方向除了跟焓变有关,还和熵变有关。但是单独地去看焓变或者是熵变,又不可以作为自发进行的判断依据。教材当中给我们一个资料卡片,自由能和化学反应的方向。其实是要综合考虑体系的焓变和熵变,它也叫做自由能的变化,有兴趣的同学可以仔细的去研读一下大学的内容,或者是以这个资料、卡片为内容进行研究。
以上就是今天的全部内容,如果有疑问可以留言,也欢迎大家积极转发。
,