美国生物学家乔治 · 戴利曾说:如果20世纪是药物治疗时代,那么21世纪就是细胞治疗的时代。
造血干细胞的概念
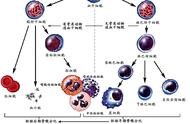
造血干细胞,顾名思义,就是所有血液细胞的老祖宗。其实它也是各种免疫细胞的祖宗,可以发育成各种髓细胞和淋巴细胞,同时还具有很强的自我更新能力。
造血干细胞是个非常富有神秘色彩的概念,不像大家所想象的那样是个现代词汇,最早提出于十八世纪,并引发了生命科学界长达两个多世纪的旷日持久的不懈探索,与人类对血液系统和免疫系统的认识密切相关。
早在1774年,休森就提出了“造血细胞起源定位”的问题,认为血细胞起源于淋巴组织;
1846年,胚胎学家韦伯和克里克尔证明肝脏是造血的的主要部位;
1868年,诺伊曼和比萨彼若分别提出了骨髓是成人造血的重要部位的观点,但直到十九世纪末才得到广泛接受;
1898年帕彭海姆采用改良若曼诺斯基染色法,追踪到了原始单个核细胞,并认为这是所有血细胞的共同始祖细胞;
1960年,加拿大科学家蒂尔和麦卡洛克发明了著名的脾集落生成单位证实确实存在有一种具有再植和多向分化能力的细胞,即造血干细胞。这项工作于1960年发表于Radiation Research杂志
此后,科学界对造血干细胞的研究不断深入,认识也在不断地加深,因为整个造血调控的机制是多层次复合网络式的,整体的各器官、组织、细胞、分子、亚分子等多层次都有影响造血调控机制的因素。
造血干细胞也有了现代的新定义:造血干细胞是机体内最独特的体细胞群,具有极其高度的自我更新、多向分化、跨系分化与重建长期造血的潜能,以及损伤后再生的能力;此外还具有广泛的迁移和特异性的归巢特性,能优先定位于相应的造血微环境中,并以非增殖状态和缺乏相关抗原的方式存在。
造血干细胞的特点
间充质干细胞是一种可用于移植的成体干细胞。
第一,必须具备重建造血功能。当一个机体完全失去造血功能后,只要还有造血干细胞存在或者有造血干细胞被植入,就有可能恢复造血免疫功能并维持正常造血。
第二,具备高度地自我更新的功能。目前,造血干细胞大规模扩增技术没有实现。99.5%的造血干细胞处于静止状态,不进行DNA的合成和有丝分裂,它们只是静静地待在造血小环境里。
第三,具备“回家”的能力。造血干细胞可以自己找到自己的“家”,也就是适合自己生存的地方,这就是我们所说的“归巢”。就像识途老马一样,知道自己的家在哪里,从自己的家里游出,在外周血中“游荡”一圈,再寻找到并进入微环境适宜的“龛”中,并定居其中。
最后,没有特异性的形态学特征。是否是造血干细胞,不能简单地通过细胞形态来判断,也不能通过特定的表面标志物来判断。基本上,在基础研究和临床应用领域,一般认为高表达CD34的造血细胞是造血干细胞(其实,也有少数造血干细胞不表达CD34)。

造血干细胞从哪儿来
造血干细胞最早从哪儿来呢?当然最早是来源于发育的胚胎。其实这跟没说一样,人由一个受精卵发育的胚胎而来。当受精卵开始分化为胚胎和胚外结构的同时,就开始了向造血干细胞方向分化,出现于胚外结构的卵黄囊血岛,原始的血管网出现在外层,最早的造血干细胞出现在内层。在胚胎发育的第2个月末,胎肝的造血能力逐渐上升,脾脏则在第3个月参与造血,胸腺和淋巴结在胚胎的第4个月开始参与造血。实际上造血干细胞最多的,当属骨髓。从妊娠第2-3月开始,骨髓就开始发育,7个月时,骨髓腔就充满了富含造血干细胞的红骨髓,从此,骨髓成为主要的造血器官并保持终生。肝脏里的造血干细胞经血液循环迁移,定居于骨髓中。
简单的说,造血位点迁移路径就是:卵黄囊→胚肝→骨髓。那么,在骨髓中的造血干细胞,如何一边维持自己的数目和特点,一边分化增殖为机体提供源源不绝的血液细胞呢?
目前占统治地位的学说是“不对称分裂(Asymmetric cell division,ACD)”。当一个造血干细胞分裂成两个子细胞,这两个子细胞还是响当当的造血干细胞,可以继续保持干性,这个过程叫自我更新;而另一个分裂方法是,其中有一个或两个子细胞则开始分化,摇身一变,成为短期造血干细胞或造血祖细胞,最终分化形成很多更下游的造血祖细胞,并向髓系和淋巴系分化,最终分化红细胞、血小板、粒细胞和淋巴细胞等成熟细胞,这个过程叫多向分化。如果造血干细胞分裂时,一个子代细胞自我更新,而另一个子代细胞多向分化。这个就叫不对称分裂。

一旦造血干细胞变成早期的造血祖细胞,就恢复对称分裂,开始增殖。随着造血祖细胞增殖能力的提高,自我更新的能力就越加下降,边增殖边分化,最后完全失去自我更新能力。造血祖细胞,只能在体内短期的重建造血,而不能长期或永久的重建造血。
造血干细胞的研究历史
正常人体每天各种血细胞更新巨大。一个体重70kg的人,每天更新10亿个血细胞,其中包括2000万的红细胞、4000万的血小板、700万的粒细胞和其他12个不同种类的血细胞。仅靠很少量的造血干细胞的自我更新和多向分化,以及造血祖细胞的大量扩增,血细胞制造就可以完成。人体内的造血细胞每时每刻都必须要进行扩增,才能保障机体的正常生理功能。
1. 造血干细胞的研究简史
在临床上,造血干细胞移植应用于治疗多种严重疾病。最广为人知的便是骨髓移植治疗白血病。其实,最早造血干细胞移植的却是治疗辐射病。
1945年,美国在日本投下原子弹后,造成大量辐射病病人。原子弹辐射摧毁了病人的免疫系统,失去了自我造血的能力。有人尝试利用骨髓移植治疗辐射病,取得成功。
1950年,科学家们发现将骨髓细胞移植到遭受致死剂量辐射的动物,发现能够挽救生命,重建骨髓造血免疫系统。
1958年,法国科学家对6名放射性意外伤者进行了骨髓移植,4名患者存活。
1967年,多纳尔–托马斯完成第一例骨髓移植,后于1990年获得诺贝尔医学和生理学奖。
1975年,认识到组织相容性匹配具有减少移植排斥和移植物抗宿主病的重要作用。
1980年,第一例非血缘异基因造血干细胞移植。
1989年,第一例脐血干细胞移植。
1998年,第一例单倍体相合异基因造血干细胞移植。
一般情况下,对成人来说造血干细胞主要存在于扁平骨的红骨髓中,一个成人的红骨髓一般总量为3000g。一般会以CD34 ,也就是大量表达CD34蛋白的造血细胞作为造血干细胞的标志。国际上在这个问题上的共识是,临床标准输入量是2X10*5个细胞/kg体重。也就是说一个50kg的人,如果要进行造血干细胞的移植的话,需要1000万个CD34 的细胞。
除了骨髓外,正常人体的外周血中也有少量的造血干细胞。如果用“动员剂”动员骨髓中的造血干细胞,使其释放到外周血中,我们就可以从外周血获得造血干细胞了。一般动员剂会使外周血中的CD34 的细胞增加20~30倍。
除了骨髓和外周血动员,造血干细胞还有一个重要来源还有就是脐血。足月的胎儿在分娩时,造血干细胞还处于从胎肝向骨髓转移的过程中,所以在脐血中会含有一定量的造血干细胞。一份100ml的脐血含CD34 的细胞为40-200万个,因此,一份脐血的造血细胞至少需要扩增10~20倍才能符合移植的需求。
2. 造血干细胞移植的要求
我们知道,供者和受者的细胞在遗传学来源上不同,它们会识别"异己"。如果想要成功地进行造血干细胞移植治疗,捐献者与患者之间的HLA型别要相合。如果不合,移植后就会产生严重的移植物抗宿主反应,甚至危及患者的生命。
人类白细胞抗原(HLA)在
主要组织相容性抗原里面起最主要的作用,HLA的基因位于第6号染色体,通过细胞内转录到细胞表面表达HLA蛋白,从而导致不同个体间细胞表面HLA抗原的不同。
HLA遗传方式是从父母各得到“一串基因”,目前实验室常规进行检测的为A、B、C、DRB1、DPB1等基因。
父亲或母的两串HLA基因可随机分配给每一个子女。从理论上讲,父母和子女
之间均为HLA半相合或称单倍体相合,而子女之间1/4为全相合,1/2之间为半相合,1/4之间为不相合。
HLA分型就像血型,但是比血型要复杂。由于不同种族、不同个体的HLA千差万别,必须采用一定的方法对捐献者和患者的HLA型别进行确定,从而选择与患者HLA相配合的捐献者进行移植,这是造血干细胞移植治疗成功的关键。人类非血缘关系的HLA相合率是几百分之一到万分之一,在较为罕见的HLA型别中,相合的几率只有几十万分之一。
这里需要指出的是,中国因为独生子女的政策,导致寻找到全相合供者的概率较小,因此,中国学者黄晓军等另辟蹊径,在单倍体(半相合)移植上做出了卓越的成就,单倍体相合移植不仅在数量上,而且在质量上均越居世界先进行列,拥有着国际发言权。
造血干细胞的用途
造血干细胞,除了重建造血和免疫系统,还可以向非血细胞系列分化。从1997年开始,各国科学家不断的研究出造血干细胞可以向肝脏细胞、脑的星形胶质和少突胶质细胞、肌肉前体细胞、心肌细胞、毛细血管、以及小动脉中的内皮细胞和平滑肌细胞分化。
在造血干细胞的研究还有另一个热点,就是造血干细胞的体外扩增。这样就可以通过自储少量健康的造血干细胞用于制造血小板、红细胞和各种免疫细胞。用于造血移植、成分输血、治疗癌症和自身免疫病。
血液一直被人类看做是生命的源泉,作为血液之源,造血干细胞的研究对我们人类的健康长寿至关重要,也是目前为止在干细胞领域研究最多,应用最多,应用前景最广最光明的一个方向。