第三单元 物质构成的奥秘
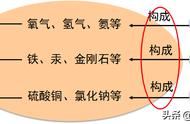
一、分子和原子 :1、构成物质的粒子有三种:分子、原子、离子。水是由水分子构成的;铁是由铁原子构成的;硫酸铜和氯化钠都是由离子构成的物质。
2、分子是保持物质化学性质的最小粒子;原子是化学变化中的最小粒子。区别在于:在化学变化中,分子可以再分,而原子不能再分。注意:由原子构成的物质,原子也是保持物质化学性质的最小粒子;如保持铁这种物质的化学性质的最小粒子,是铁原子
3、分子(或原子)具有的特点:①分子的质量和体积小;②分子在不断地运动(温度越高,分子运动越快);③分子之间有间隙(气体分子间距离最大,固体分子间距离最小)。④同种分子,性质相同,不同种分子,性质不同。
※ 不能笼统地说分子大,原子小,要看具体情况。
3、分子由原子构成:由H2O 可知(体会两种说法的区别与联系):水分子由氢原子和氧原子构成;一个水分子由两个氢原子和一个氧原子构成。再如O2由可知:氧气由氧分子构成,一个氧分子由两个氧原子构成。
二、原子的构成:
1、构成原子的粒子有:质子、中子、电子。[氢原子核中无中子]
原子是由居于原子中心的带正电的原子核(通常由质子和中子构成)和核外带负电的电子构成。电子在核外作高速的无规则的运动。
一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,中子不带电。由于原子中,质子所带的正电与电子所带的负电,电量相等,电性相反,所以,整个原子对外不显电性。
3、记住两个等式:原子序数 = 核电荷数 = 质子数 = 核外电子数
相对原子质量 ≈ 质子数 + 中子数 电子的质量是质子质量的1/1836
4、某原子的相对原子质量(以氢原子为例):
氢原子的相对原子质量等于一个氢原子质量除以一个标准碳原子(含有六个质子和六个中子的碳原子)质量的十二分之一。
相对原子质量的单位是“1”,通常不写出来。
相对原子质量不是原子的实际质量,但它与原子的实际质量成正比。
三、离子:
1、电子在原子核外是分层排布的,1—20号元素的原子,各原子第一层最多排2个电子,其它层最多排8个电子。对于原子来说,排布的依据是质子数 = 核外电子总数
2、元素的最外层电子数,决定了元素的化学性质;最外层电子相同的原子,化学性质相似。
3、稀有气体元素最外层为8个(氦只有一层,为2个),在化学反应中既不容易得到也不容易失去电子,化学性质稳定。
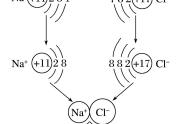
金属元素的最外层电子数一般少于4个,容易失去电子,形成阳离子,如 Na+ Mg2+
非金属元素的最外层电子数一般多于4个,容易得到电子,形成阴离子,如 Cl― O2―
所以,阳离子中质子数 > 核外电子总数 阴离子中质子数<核外电子总数
Fe(铁原子)、Fe2 (亚铁离子)、Fe3 (铁离子)因核电荷数相同,都称为铁元素,但最外层电子数不同,所以他们的化学性质也不同。
4、离子的概念:带电的原子或原子团(CO32― 、 SO42―、OH―、NO3―、NH4+)。由离子构成的物质,阴离子和阳离子所带的正、负电荷数目相等,电性相反,所以,物质对外不显电性。如Na+与Cl―形成NaCl;Na+与CO32―形成Na2 CO3 Mg2+与Cl―形成MgCl2
四、元素
1、元素是具有相同质子数(即核电荷数)的一类原子的总称。因此,不同的元素的差别在于核电荷数不同,或说质子数不同。
2、物质由元素组成,由分子、原子、离子构成。如水是由氢元素和氧元素组成;水是由水分子构成,铁是由铁原子构成,氯化钠是由钠离子和氯离子构成等。
3、地壳中含量最多的四种元素依次是氧硅铝铁——“养闺女贴(心)”;生物体内含量最多的元素是氧元素,其次是碳元素。
4、记住1—20号元素之外的十种元素P75 Mn Fe Cu Zn Ag Ba Pt Au Hg I
书写元素符号——“一大二小”
元素符号既表示元素(宏观,只讲种类,不讲个数),也表示原子(微观,既讲种类,也讲个数) 如:H 可表示三种意义 氢元素 氢原子 一个氢原子。
举一反三:P可表示三种意义 磷元素 磷原子 一个磷原子。
但如果元素符号前面有数字,则只表示原子个数,如2H只表示:两个氢原子。类推……
元素可分类为金属元素和非金属元素,也可以将稀有气体元素单独列出来,分为三类:金属元素、非金属元素、稀有气体元素。