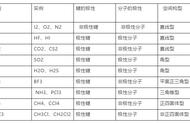
在平时的教学中,中学化学题目往往很少去比较物质的能量大小,考纲更侧重于比较稳定性以及键能的大小,而后者大家都耳熟能详。

首先用这张图解释一下为啥能量越低越稳定,如果说相同的一个物质,能量因为某种原因高了一点那么它达到过渡态需要克服的活化能Ea就相对来说更低了,更容易去反应了。所以物质本身能量越低越稳定,而物质稳定的原因是破坏这种物质所需要的能量多,也就是破坏其键能所需能量多,难破坏,就说物质稳定。所以物质的键能越大,其本身的能量越低。键能代表的是想要破坏化学键所需要的能量。当然,我们大家都知道键能越大,化学键结合的越牢固,破坏化学键需要的能量越多,对应分子越稳定。
接下来我们来看看下面的这道题目:

首先是原子核间距的判断:由于Cl、Br、I均为同主族元素,原子半径易知依次增大,Cl2、Br2、I2分子中成键原子的核间距依次增大。
其次是能量的判断:

共价键键能越大,分子越稳定,对应分子本身的能量越低。易知答案选A。
深层次探讨(仅供参考):物质总能量越高,键能就越低吗?
物质总能量即物质的内能(或热力学能),是物质内各种形式能量的总和,包括分子动能、分子势能、分子内电子的动能和势能,原子核能等等,随着认识的深化,还在发现新能量形式,内能的绝对值难以确定;而键能是指在常温下(25℃ ) 基态化学键分解成气态原子所吸收的能量,或者气态原子形成基态化学键释放的能量,这是两个相反的过程,键能可通过实验与计算的方法得到.
这两种能量大小之间有什么关系?
部分老师总结为:物质总能量越高,键能就越低.所依据理由大致有如下两个方面:
1. 物质的总能量越高,越不稳定,在化学反应中越活泼,越易断键,键能就越低.
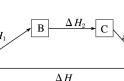
2. 在计算反应热ΔH 时常采用两个公式:
ΔH = 生成物总能量 - 反应物总能量;
ΔH = 反应物键能 - 生成物键能,
这两种方法计算的 ΔH 相等,若生成物总能量> 反应物总能量,则生成物键能 < 反应物键能,反应物与生成物相比,总能量越高,键能就越低.
我认为理由 1 欠严谨,大量的惰性物质总能量也会很高,化学性质会活泼吗? 再者若只是核能高导致总能量高,而电子的动能与势能并不高,物质化学性质未必活泼.
理由 2 中用键能计算反应热仅是一种估算,特殊情况下,算出的ΔH 与真实的 ΔH正负都不同.
当然大多数情况,键能计算的 ΔH 与真实的 ΔH 接近,但不能随意延伸,如,有的教师延伸出:已知 1 mol NH3键能> 1 mol H2O 键能,则相同 条件下,1 mol NH3总能量 < 1mol H2O 总能量,这个结论就更值得商榷.
试问:1 mol C10H22键能必定大于 1 mol CH4,但是总能量谁大呢? 单从核能角度 C10H22也大于 CH4.
判断物质间总能量的大小,通常是通过一个变化过程来进行,若该变化是放热过程,则反应物总能量大于生成物总能量,若为吸热过程则反之.
例如,H2(g) + Cl2(g) = 2 mol HCl(g) ΔH < 0
总能量:1 mol H2(g) + 1 mol Cl2(g) > 2 mol HCl(g),键能:1 mol H2(g)+ 1 mol Cl2(g) < 2 mol HCl(g).
在中学的变化过程中元素质量是守恒的,用于比较总能量的物质之间元素种类和质量应当守恒.
我认为在中学阶段可以这样表述:对组成元素种类和质量相同的物质,一般总能量越高,键能越低. 如,1 mol H2(g) 与 1 mol Cl2(g) 混合物与 2 mol HCl( g) 的比较就符合这个结论. 虽然 1 mol NH3与 1 mol H2O的键能可以进行比较,但因为元素种类不同,通常无法直接比较两者总能量大小.
为何要加"一般"二字呢,因为这个表述也有反例,例如,总能量 1 mol H2O( g) 大于1 mol H2O( L) ,但这两者键能却是相等的,因为液态水变成气态水吸收的能量不应属于键能.
再举一反例:H2(g) + I2(g) = 2 mol HI(g) ΔH < 0,而H2(g)+ I2(s) = 2 mol HI(g) ΔH > 0. 查阅资料显示,键能:1 mol H2(g) + 1mol I2(g) < 2 mol HI(g),但总能量的大小却因为 I2的状态不同而不同. 根本原因是当物质种类和质量一旦确定,键能就确定了,不因温度、状态改变而改变;但总能量会因为温度、状态等不同而不同,所以总能量大小关系就难以确定.