钠,化学式Na2O,是一种活泼金属元素。钠在自然界分布非常广泛,其中约有一半的分布在海水中。钠的用途非常广泛,例如制造玻璃、肥皂、洗涤剂等,也可用作化工原料和各种医药。除了这些用途外,钠还是一种重要的资源。例如钠资源就是重要的化工原料,被广泛应用于化学、制药、轻工等多个领域。
那么,为什么钠遇到水会发生剧烈反应呢?在介绍这个问题之前我们先来看看钠和水反应的条件。

一、反应的条件
钠和水反应需要满足一些条件,才能生成具有强烈氧化性的物质,具体的条件如下:
(1)水:钠的物质的量浓度必须小于0.0025 mol/L;
(2)水溶液温度:钠遇水发生反应的温度必须是0℃,否则不能发生反应;
(3) NaOH溶液浓度:钠遇到水溶液中的 NaOH时会生成氢氧化钠,会与水反应生成氢氧化钠,氢氧化钠会与水发生反应生成氢氧化钾,则会与水发生反应生成氢氧化钠;
(4)空气:钠遇到空气中的氧气时会发生剧烈反应,并可导致爆炸;
(5)催化剂:钠和水反应生成氢氧化钠时必须有催化剂才能发生反应。
这四个条件缺一不可。比如,在实际操作中,为了避免产生氢气和二氧化硫气体,可以用饱和 NaOH溶液来吸收空气中的水分,来完成一系列的化学反应。在现实生活中,还有另外一种情况也能够使得钠和水发生剧烈反应——加热。比如大家熟悉的酒精灯就是利用火焰加热来达到将液体加热至沸腾的效果。为了避免引起爆炸以及其它事故,为了安全起见,我们也需要用酒精灯来加热液体。另外还有一些需要用到酒精灯的场合也可以利用这种加热原理来进行实验。
除此之外还有许多方法能够使溶液中的溶质和溶剂分离开来——比如利用蒸发结晶法、电渗析法、离子交换法以及超临界流体萃取法等。

1、蒸发结晶法
在实际操作中,我们可以采用蒸发结晶法,将溶质和溶剂分离开来。
首先,需要准备一个蒸发皿(我们平常吃的带盖的白瓷碗),将要用到的钠放入锅中加热。等到钠和水的温度达到100℃时,加入氢氧化钠。此时加热装置中会产生大量蒸气,在蒸气的作用下,部分水就会蒸发出来。
然后将蒸发皿放入试管中(或者用注射器),试管中只剩下部分 NaOH溶液。这样我们就可以将 NaOH溶液与水进行分离了。接下来可以用滴定法来测量钠与水之间的质量关系:如果钠的物质的量浓度为0.0025 mol/L,则可以获得饱和 NaOH溶液;如果钠和水发生反应生成了氢氧化钠,则得到不饱和 NaOH溶液。但是这些物质是不会同时存在于同一支试管中的(我们在前面讲过一个试管中只能有一种物质)。当我们将一个含有钠的试管放入另一个含有氢氧化钠试管中时,钠就会和水发生反应生成了氢氧化钠。
随着反应的不断进行,在反应过程中会产生许多杂质,我们需要将这些杂质除去。根据不同杂质的性质,可以采用不同的方法来除去它们。
2、离子交换法
离子交换法也是钠和水反应的一种方法,由于离子交换剂的种类不同,我们将其分为树脂法和交换树脂法两种。
树脂法是以天然高分子材料为基础的,一般具有多孔、大孔结构,而交换树脂是由碳、硅等元素组成的大分子聚合物。当钠和水以一定比例混合时,会与这种大分子聚合物产生化学反应——钠与树脂上的羟基(- OH)结合。
钠和树脂上的羟基结合之后,钠的物质量浓度就降低了,因此溶液的温度也会相应下降。因此当钠和水以一定比例混合时,溶液中的钠含量会降低。这就好比在一个封闭的容器里装满水之后,水中的溶质含量会降低一样。
不过这种方法虽然在实际操作中应用得比较广泛,但是我们在此过程中也发现了一个问题——树脂法的成本比较高。
一般来说,每生产一吨树脂需要花费10万元左右。而这种方法只适用于生产一些小型、廉价且成分单一的物质。如果使用大型且含杂质多(比如强酸、强碱等)的树脂法生产一些价格较高的物质则很难进行工业化生产。
总的来说,离子交换法可以使钠与水反应生成氢氧化钠与二氧化碳,但是生成物也有一定程度上对环境有害。所以如果想要更安全地进行化学反应就需要在反应之前对溶液中加入氧化剂、催化剂以及 pH值等因素进行调节。
二、反应速率
钠在水中发生的反应,是通过钠离子的水解产生氢气。钠和水反应后,生成的氢气比钠少,这是因为随着水解程度的增加,反应速度下降。
水解反应有一个特点,那就是可以将两个相互接近的分子分开成两个单独的分子。当两个互不相关的分子开始接触时,由于相互间没有很大的压力,因此可以彼此分离。这就是为什么钠和水反应后会生成氢气。
另外一个特点是生成的氢可以将水完全电离(生成自由电子),这样水就会变成弱电解质。而这个过程需要较长的时间,因为弱电解质必须在水中完全电离才能发生。
所以钠和水反应时所用到的时间较长,大约为1小时以上。这也是为什么在较长时间后钠不能完全电离时会发生剧烈反应(燃烧)的原因所在。

1、水解速度
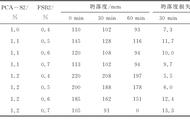
(1)根据图2所示,反应前,钠离子水解的速度为3.44×10-8m/s,在反应进行中,由于钠离子浓度不断增加,其水解速度不断下降,当达到水的浓度极限时,钠水解速度降至0.01m/s。由图3可以看出,在反应开始的5分钟内,钠离子水解的速率达到了峰值。此后钠离子水解速率逐渐下降。
(2)根据图3可知,随着水解程度的增加,生成的氢气量逐渐减少。在反应进行中,当钠离子浓度达到水的浓度极限时,钠离子的水解速率仍未停止。至反应结束时,钠离子水解速度仍然较大(4.00×10-8m/s)。因此可认为当水的浓度大于等于0.04 mol/L时便可以停止反应。
(3)在水解过程中钠离子浓度不断增加,而氢气量却逐渐减少。这是因为当浓度过大时(大于0.02 mol/L)会出现明显的抑制现象(氢氧根离子被抑制)。在这种情况下不能继续进行下去,因此需要在浓度合适的时候停止反应,然后再缓慢增加溶液中钠离子的浓度。
2、反应速率与水解程度之间的关系
从上述过程可知,反应速率与水解程度是成正比的。而不同的物质在水溶液中水解程度是不同的,并且有些物质水解程度很大,有些物质水解程度很小。这就导致了反应速率也有一定的差异。
以钠为例,水解时 NaOH和H2O可电离出H 、OH-等活泼离子,所以生成的氢气要比水少得多。为了探究这个问题,我们设计了两种不同的实验,来证明这个现象。
这两种实验中分别加入了稀硝酸和浓硫酸,使水变为稀硫酸溶液(如图3所示)。实验结果表明,随着稀硫酸和硝酸浓度的增加,反应速率也会随之增加,但反应速率不会超过钠离子的水解速度。
再以稀硝酸为例,相同浓度和相同条件下,加入稀硝酸时钠离子和水发生水解程度最小,也就是说水的水解速度最快。因此当钠加入到稀硝酸中时会生成氢气最少。这一实验结果与前面的实验结果一样,说明钠在稀硝酸中和稀硝酸溶液中有同样的水解速度。
三、反应物
钠与水的反应,实际上就是钠和水之间的化学反应。这个反应有两个特征:
1.首先要有钠离子存在。在通常情况下,一个水分子可以与一个钠离子结合生成一个分子,这个结合后的离子叫做该分子的水分子。当把这种结合的水分子从溶液中取出后,如果要继续与钠离子结合,就需要再加入盐才能继续反应了。盐对钠的存在起着保持和促进的作用。
2.钠与水之间除了存在结合关系之外,还存在着交换关系。不同溶液中,钠离子和氢离子浓度之比(Na/H)可以用来表示溶液中的钠离子和氢离子之间的平衡关系。
这里的平衡关系是指在溶液中,两个具有不同离子浓度比例的钠离子与氢离子之间建立起的化学平衡状态。因为溶液中钠离子浓度很高,而氢离子浓度很低,所以可以把这个平衡状态称为“非零”。
在非零状态下, Na/H=10∶1以上时,氢离子浓度才大于0;在非零状态下,钠离子浓度小于10∶1时,氢离子比大于0;当二者接近10∶1时,钠元素从氢离子处转移到钠原子处。
比如在 Na/H=10∶1、钠原子处、两者均为非零值的溶液中进行反应时, Na/H=10∶1时,氢离子比接近于0;当两者为零值时,氢离子比则接近于1;而当两者均为零值时(即没有其他物质存在),则氢离子比接近于1。当然现实中不可能存在这样理想的溶液。
根据上述规律,我们可以在实验室中人为地创造一个比较理想的溶液环境,使其在一定条件下与一定浓度的Na2O反应。
由于我们不能人为地创造出溶液环境来验证这个规律,因此需要人为地设计一些实验条件。比如我们可以把实验室中的空气置换成含有微量氧气的空气溶液或在实验室中人为地引入二氧化硫等气体溶液(浓度不宜太大)以促进反应发生。
上述实验装置见图1、图2。用该装置模拟非零状态下钠和水反应的情况如下:
上述反应是钠与水反应的基础条件,但事实上很多实验条件都是根据这个反应条件而设计的:
1.如果要进行一些其他性质实验的话,就必须用到其他实验装置。因此在实验过程中我们要设计好反应装置和相关实验步骤;
2.如果在实际应用过程中需要改进某种设备和装置,则可考虑使用新设备、新仪器或者与之相关的改进技术来解决问题。