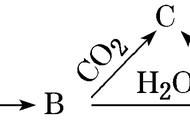1.钠及其化合物与人们的生活密切相关,某同学对其认识不正确的是( )
A.碳酸氢钠常用于治疗胃酸过多症
B.热的纯碱可去除油污
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.金属钠着火时,使用泡沫灭火器来灭火
解析D项,Na燃烧生成的Na2O2能与CO2反应生成O2,因此金属钠着火时不能用泡沫灭火器灭火,应用沙土掩埋法灭火。
答案D
2.关于钠元素的单质及其化合物的叙述不正确的是( )
A.钠是银白色金属,质软,熔点相对较低,密度比水小
B.Na2O2属于碱性氧化物
C.金属钠在空气中长期放置,最终变为碳酸钠
D.Na2O和Na2O2都能由金属钠和氧气化合生成,但Na2O和Na2O2中氧的价态不同
解析Na2O2属于过氧化物,不属于碱性氧化物,B项不正确;金属钠切开后置于空气中,发生反应:4Na+O2===2Na2O、Na2O+H2O===2NaOH、2NaOH+CO2===Na2CO3+H2O、Na2CO3+10H2O===Na2CO3·10H2O、Na2CO3·10H2O===Na2CO3+10H2O,C项正确;Na2O2中O为-1价,Na2O中O为-2价,D项正确。
答案B
3.某实验小组通过下图所示实验,探究Na2O2与水的反应:

下列说法正确的是( )
A.②中的大量气泡主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
解析过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O===4NaOH+O2↑,所以②中的大量气泡主要成分是氧气,A项错误;过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠是碱,使酚酞变红,B项错误;④中红色褪去,可能原因是过氧化钠和水反应生成的过氧化氢具有强氧化性,能氧化有色物质,漂白褪色,C项正确;过氧化氢在二氧化锰作催化剂的情况下分解生成水和氧气,即验证过氧化钠和水反应生成的过氧化氢,不是降低了水中氧气的溶解度,D项错误。
答案C
4.焰火“脚印”“笑脸”“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是( )
A.非金属单质燃烧时火焰均为无色
B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察
D.NaCl与Na2CO3灼烧时火焰颜色相同
解析H2在O2中燃烧时,火焰为淡蓝色,A项错误;只有部分金属元素有焰色反应,B项错误;钾元素的焰色反应透过蓝色钴玻璃滤去黄光干扰,C项错误。
答案D
5.在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是( )
A.将一小块Na投入水中,钠浮于水面,说明钠的密度比水小
B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱
C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na没有Cu活泼
D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成
解析钠比铜要活泼,将一小块Na投入CuSO4溶液中,钠首先与水反应生成氢氧化钠和氢气,然后氢氧化钠与硫酸铜溶液反应生成蓝色沉淀氢氧化铜,所以得不到铜,C项错误。
答案C
6.已知硫酸亚铁溶液中加入Na2O2时发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+。下列说法正确的是( )
A.该反应中氧化剂是Na2O2,还原剂是FeSO4
B.若Fe2+失去4 mol电子,生成氧气的体积约为22.4 L
C.4 mol Na2O2参加反应,共得到6 mol电子
D.反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色
解析该反应中Fe2+失电子作还原剂,Na2O2中的O元素既得电子又失电子,故Na2O2既作氧化剂又作还原剂,A项错误;未指明温度和压强,故无法计算生成的氧气的体积,B项错误;该反应中转移6e-,且只有Na2O2中的O元素得电子,故4 mol Na2O2参加反应,共得到6 mol电子,C项正确;反应过程中Fe2+直接被氧化生成Fe3+,形成Fe(OH)3沉淀,反应过程中无Fe(OH)2生成,D项错误。
答案C
7.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2===Na2SO4、2Na2O2+2SO3===2Na2SO4+O2。据此,你认为下列化学方程式中正确的是( )
A.2Na2O2+2N2O4===4NaNO3
B.Na2O2+2NO2===2NaNO2+O2
C.2Na2O2+2N2O3===4NaNO2+O2
D.2Na2O2+2Mn2O7===4Na2MnO4+O2↑
解析Na2O2具有强氧化性,可与还原性物质发生氧化还原反应,Na2O2还可与最高价氧化物反应生成相应的盐和氧气。N2O4中的N为+4价,因此和Na2O2反应生成+5价N,即生成NaNO3,A项正确;Na2O2可把NO2氧化为NaNO3,B项错误;Na2O2可把N2O3氧化为NaNO3,C项错误;化学方程式中原子不守恒,应为2Na2O2+2Mn2O7===4NaMnO4+O2↑,D项错误。
答案A
【题外之音】
碱金属元素性质及考点指导
Na在金属活动性顺序中排第3位,是还原性极强的物质。其能与空气中的O2、CO2、水蒸气反应
Na2O2是常见的有极强氧化性的物质,易在溶液中氧化还原性物质,如Fe2+、S2-、SO等。注意其与H2O、CO2反应中,Na2O2既作氧化剂,又作还原剂
NaOH是四大强碱之一。表现为碱的通性,如常用于NH的鉴别、检验含醛基物质时Cu(OH)2悬浊液的制备、中和滴定实验、中和热测定实验、油脂的水解等
Na2CO3俗称纯碱,水解程度强。常考查在溶液中的离子浓度关系,用来调节溶液的pH,或与NaHCO3作性质对比实验
NaHCO3俗称小苏打,是易产生气体的物质,“发泡”性强,可用作泡沫灭火剂、馒头发泡剂等
8.在封闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A.Na2CO3和Na2O2
B.Na2CO3和NaOH
C.NaOH和Na2O2
D.NaOH、Na2O2和Na2CO3
解析设有2 mol NaHCO3和2 mol Na2O2,2 mol NaHCO3受热分解成1 mol Na2CO3、1 mol CO2,1 mol H2O,1 mol CO2 1 mol H2O分别与2 mol Na2O2反应生成Na2CO3和NaOH,故B项正确。
答案B
9.下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验装置、分析实验原理,并判断下列说法和做法,其中不科学的是( )

A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热不久就能看到A烧杯的澄清石灰水变浑浊
D.整个实验过程中没有发现A烧杯的澄清石灰水变浑浊
解析Na2CO3受热不分解,而NaHCO3受热易分解生成Na2CO3、CO2和H2O。大试管中温度高于小试管,甲应为NaHCO3,乙为Na2CO3,A中不变浑浊,B中变浑浊,A、D两项正确,C项错误;无水硫酸铜粉末吸水得到蓝色CuSO4晶体,可证明有H2O产生,B项正确。
答案C
10.通过测定混合气中O2含量可计算已变质的Na2O2(含Na2CO3)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )