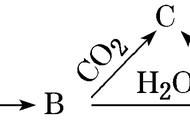A.干燥管b中装入碱石灰
B.Q气球中产生的气体主要成分为O2、CO2
C.测定气体总体积必须关闭K1、K2,打开K3
D.读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
解析加入硫酸与样品反应在Q气球中得到二氧化碳和氧气,用碱石灰吸收二氧化碳和水蒸气,在量筒Ⅱ中排水测氧气的量,进而计算过氧化钠的量,选项A、B都正确;测定气体的总体积是利用Q气球的膨胀将瓶中的空气挤入右边进行排水量气,所以必须关闭K1、K2,打开K3,C项正确;读完气体总体积后,关闭K3,缓缓打开K1,还要再打开K2,才可观察到Q气球慢慢缩小,原因是不打开K2体系是密闭的,气球体积无法减小,D项错误。
答案D
11.某课外活动小组做了如下关于钾的探究实验。
(1)钾与水反应
实验中钾常会着火燃烧,并发生轻微爆炸,由此现象可以得出的结论是__________________________________________________
(任写一个),该反应的离子方程式是____________________。
(2)钾与氧气反应的实验
经查找资料知:钾与氧气反应可能生成K2O、K2O2、KO2。
a.取一定量的钾在空气中点燃,使其充分反应;
b.将生成物研成细粉备用;
c.常温下,利用如图所示装置探究生成物的成分及其含量。

据此回答下列问题:
①使细粉末与水反应的操作是__________________________。
②测量气体体积时应注意的事项是______________________。
③若钾与氧气燃烧的产物为K2O2、KO2,取燃烧产物3.94 g进行上述实验,测得气体的体积为868.0 mL,则KO2的质量分数约为________(已知:常温下,气体的摩尔体积为24.8 L·mol-1)。
解析(2)③设样品中K2O2为x mol,KO2为y mol,根据反应2K2O2+2H2O===4KOH+O2↑,4KO2+2H2O===4KOH+3O2↑,则有110x+71y=3.94①;+=②,联立①②得x=0.01,y=0.04,故KO2的质量分数为×100%≈72.08%。
答案(1)钾与水反应放热(其他合理答案也可)
2K+2H2O===2K++2OH-+H2↑
(2)①将仪器A向左倾斜,使水与样品充分接触
②将气体冷却至室温;移动量筒使量筒内外液面相平,使量筒内的气体压强与大气压强相等;平视读数
③72.08%
12.(2018·长沙月考)现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
回答下列问题:
(1)装置A中液体试剂选用________________,理由是__________________________________________________
__________________________________________________。
(2)装置B的作用是______________________________。
装置E中碱石灰的作用是____________________________。
(3)装置D中发生反应的化学方程式是_____________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况下),则Na2O2试样的纯度为________。
解析本题的解题思路是根据氧化钠与二氧化碳气体反应无氧气生成,而过氧化钠与二氧化碳气体反应会生成难溶于水的氧气,并且用排水法测定生成的氧气的体积。所以制二氧化碳的试剂采用6 mol·L-1盐酸与CaCO3固体,不能用硫酸,硫酸与CaCO3固体反应生成的CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续。由于从A装置中出来的CO2中含有少量HCl、H2O,所以先用饱和的NaHCO3溶液吸收HCl,再用浓硫酸干燥CO2气体,由于CO2与混合物反应时会有剩余,为防止影响实验的测定结果,要用碱石灰吸收剩余的CO2气体,相关反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2,Na2O+CO2===Na2CO3。
根据2Na2O2~O2的关系可计算出生成224 mL气体时,Na2O2的质量为1.56 g,则试样纯度为1.56÷2.0×100%=78%。
答案(1)6 mol·L-1盐酸 硫酸与CaCO3固体反应生成的CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续
(2)除去气体中的HCl 吸收装置D中反应剩余的CO2
(3)2Na2O2+2CO2===2Na2CO3+O2,
Na2O+CO2===Na2CO3 (4)78%
13.小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:

Ⅰ.加热分解法
利用图甲装置,充分加热小苏打样品。
(1)仪器A的名称为________。
(2)在实验过程中,需要测量的实验数据有
①仪器A的质量;
②__________________________________________________;
③__________________________________________________。
Ⅱ.测量气体体积法
利用图乙装置,测定反应生成气体的体积。
(1)组装好仪器后,首先进行的操作为_________________。
(2)导管g的作用为__________________。
(3)为了减小实验误差,B、C中最好用____________溶液代替水。
(4)待反应结束,气体冷却至室温后,利用图示装置读取气体体积时,应注意的事项有
①__________________________________________________;
②__________________________________________________。
(5)若所取样品的质量为m g,反应前滴定管C的读数为V1 mL,反应结束后滴定管C的读数为V2 mL,则样品中NaHCO3和Na2CO3的物质的量之和为____________(气体体积均已换算为标准状况下的体积)。
解析Ⅰ.(1)仪器A是坩埚。(2)还需要测量的实验数据有“加热前,仪器A和样品的总质量”和“加热冷却后,仪器A和残留物的总质量”。
Ⅱ.(1)涉及气体的实验装置连接好后第一步是检查装置气密性。(2)导管g的作用是平衡分液漏斗与锥形瓶内的气压,使液体顺利流下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的气体体积误差。(3)由于生成的二氧化碳溶于水,造成误差,所以采用饱和NaHCO3溶液代替水,从而减小误差。(4)①读数时上下移动C管,使B、C两管液面相平,减小由于压强不同引起的体积误差;②视线与液面最低处相平,减小由于读数引起的体积误差。(5)根据碳原子守恒,1 mol碳原子对应1 mol二氧化碳,二氧化碳的物质的量为 mol,所以样品中NaHCO3和Na2CO3的物质的量之和为 mol。
答案Ⅰ.(1)坩埚 (2)②加热前,仪器A和样品的总质量 ③加热冷却后,仪器A和残留物的总质量
Ⅱ.(1)检查装置气密性
(2)平衡分液漏斗与锥形瓶内的气压,使液体顺利流下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的气体体积误差
(3)饱和NaHCO3
(4)①读数时应上下移动C管,使B、C两管液面相平
②视线与液面最低处相平
(5) mol
14.纯碱在工业上非常重要。
(1)取一定量纯碱细小粉末置于烧杯中,加入一定量的水,可以得到颗粒较大的晶体A,烧杯温度升高。理由是_____________________。
(2)从上述烧杯中得到干燥纯净的晶体A,实验程序为________(填序号,可重复使用)。
①蒸发结晶 ②放入干燥器中 ③转移到过滤器中
④用水洗涤2~3次 ⑤用乙醇洗涤 ⑥加热灼烧
(3)取13.92 g晶体A,进行热重分析,直到质量不再改变,生成物质Z,具体数据如下:
物质
样品A
T1℃时
得到物
质X
T2℃时
得到物
质Y
600 ℃
时得到
物质Z
质量/g
13.92
11.75
7.45
6.36
通过计算确定样品A的化学式是_____________________。
解析(1)温度升高,说明Na2CO3与水的反应是放热反应。(2)先过滤出晶体,再用乙醇洗涤,最后干燥即可。(3)加热到质量不再变化时物质Z为Na2CO3。设样品A的化学式为Na2CO3·nH2O
则Na2CO3·nH2ONa2CO3+nH2O
(106+18n) g 106 g
13.92 g6.36 g
(106+18n)∶106=13.92∶6.36
解得n=7,
故A的化学式为Na2CO3·7H2O。
答案(1)发生反应:Na2CO3+nH2O===Na2CO3·nH2O,反应物的总能量高于生成物的总能量,反应放出热量 (2)③⑤② (3)Na2CO3·7H2O