溶液知识点概述在之前的分享中,我强调了《溶液》这一章在中考中的重要性,所以必须重视。本章节需要掌握一些基本概念、概念理解、图形和实际问题的转化,以及基本的计算(溶质的质量分数)和溶液配制的基本流程。
溶液的定义及影响因素,溶液的组成和溶解过程,溶液与悬浊液、乳浊液的区别和联系,乳化现象,关于广义“溶解”的理解,影响溶解能力的因素,溶解规律和溶液性质,饱和溶液与不饱和溶液,溶解性,溶解度,固体物质溶解度的表示方法,结晶方法,溶液分类,结晶与结晶水合物,溶质的质量分数,饱和溶液中溶质的质量分数与溶解度的关系,配置一定质量分数的溶液的实验,有关溶液的稀释和浓缩的计算,根据化学方程式进行溶质质量分数的综合计算,十字交叉法在溶液计算中的应用。

1、溶液、溶质、溶剂
溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。溶液不一定都是无色的,例如:硫酸铜是蓝色、硫酸亚铁是浅绿色、氯化铁是棕黄色、高锰酸钾溶液显紫红色、硫酸铁溶液是棕黄色、硝酸铁溶液是棕黄色。
★溶液特征:均一性、稳定性。
a、均一性是指溶液各部分的溶质浓度和性质都相同,但溶液中分散在溶剂中的分子或离子达到均一状态之后,仍然处于不停地无规则运动状态。
b、稳定性是指外界条件(温度、压强)不变时,溶液长期放置不会分层,也不会析出固体或者放出气体。
溶质:被溶解的物质叫做溶质。例如:蔗糖溶液中的蔗糖,食盐溶液中的食盐,碘酒中的碘,盐酸中的HCl也是溶质。
溶剂:能溶解其他物质的物质叫做溶剂。例如:溶解蔗糖的水,碘酒中的酒精都是溶剂。
★一般情况下:常见的溶质为固体,溶剂为水。
溶质可以是固体、液体和气体,如:NaCl、酒精、二氧化碳、氨气。
溶剂可以是其他液体:酒精(乙醇)、汽油。
判断某物质是否是溶液的方法:
①是否是均一、稳定的混合物。②是否是一种或几种物质溶解于另一物质中。

2、溶解的过程和溶液的组成
溶质分散到溶剂中形成溶液的过程中,发生了两种变化:(1)溶质的分子(离子)向水中扩散,此过程中溶质的分子(离子)在水分子作用力下,克服分子(离子)间的作用力,扩散到水中成为自由移动的分子(离子),此过程要吸收热量。(2)已经扩散到水中的溶质的分子(离子)与水分子作用,生成水合分子或水合离子(简称为水合过程),这一过程要放出热量。
溶解过程中的热现象:
吸热溶解:如硝酸铵NH4NO3、氯化铵NH4Cl
放热溶解:如氢氧化钠NaOH、氧化钙CaO、浓硫酸H2SO4
不吸热、不放热溶解:如氯化钠NaCl
溶液的组成:
宏观上,溶液是由溶质和溶剂组成的;微观上,溶液是由溶质的溶剂化分子或溶剂化离子和溶剂分子组成。
●溶液质量=溶质质量 溶剂质量;溶液体积 ≠溶质体积 溶剂体积。
说明:
a、固体溶质溶于溶剂的部分才是溶液中的溶质,未溶解的固体则不属于溶液的溶质,根据物质分子(离子)之间存在间隙,可得出溶液体积不等于溶质体积加溶剂体积。
b、溶质可以是一种物质,也可以是两种或两种以上的物质,但溶剂只有一种。如:食盐水中溶质是氯化钠,溶剂是水;糖盐水中溶质是蔗糖和食盐,溶剂是水。
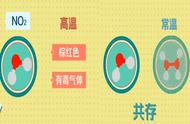
c、能与水反应的物质,其生成物是溶质。如:氧化钙CaO、氨气NH3、氯气Cl2、过氧化钠Na2O2、氧化钠Na2O、三氧化硫SO3、二氧化氮NO2与水都反应,生成物是氢氧化钙Ca(OH)2、一水合氨NH3 H2O、盐酸HCl、氢氧化钠NaOH、硫酸H2SO4、硝酸HNO3。

3、溶液与悬浊液、乳浊液的区别与联系