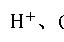正确书写离子方程式是中学生必备的基本技能之一,也是历年高考必考的考点之一,要写好离子方程式,除应遵循书写离子方程式的一般规则和规律外,还应注意一些特殊的问题。
书写离子方程式一般分为四步,即“一写”(化学方程式),“二改”(容易电离的物质),“三消”(两边相同的离子),“四查”(两边原子个数和电荷数是否相等),但其中最关键的是改写,要正确地改写离子方程式,必须掌握以下几点:
一、掌握有关书写规则
1. 搞清反应实质,防止错写。
2. 遵循质量守恒,电荷守恒,(氧化剂与还原剂得失电子守恒)。
3. 难溶、难电离物质和气体要写成分子式且注沉淀,气体的箭号
4. 若同一化学反应有多个离子反应发生,要一并写入,防止漏写。
二、掌握一些规律性的知识
1.熟记酸、碱、盐溶解性规律
(1)酸:除硅酸外,其余的酸均溶于水。
(2)碱:除KOH、NaOH、Ba(OH)2易溶,Ca(OH)3微溶外,其余均不溶。
(3)盐:K 、Na-、NH 4、NO-3、Ac-、H2PO-4、HCO-3等离子组成的盐均溶于水;氯化物除AgCl、Hg2Cl2、Cu2Cl2不溶,PbCl2微溶外,其余均溶;碳酸盐、磷酸盐、硅酸盐、亚硫酸盐除其钾、钠、铵盐溶于水外,其它盐几乎都不溶;氢硫酸盐除钾、钠、铵盐溶于水,CaS、BaS、MgS、Al2S3在水中不存在外,其余几乎都不溶。
2.熟记常见的强、弱电解质
(1)常见的强电解质:强酸:HCl、H2SO4、HNO3、HBr、HI、HClO3、HClO4;强碱:KOH、NaOH、Ba(OH)2,中强碱:Ca(OH)2;大多数的盐。
(2)常见的弱电解质:水;弱酸:HAc、H2S、HF、H2CO3、HClO等;中强酸;H3PO4、H2SO3;弱碱:NH3·H2O。
三、掌握书写离子方程式的注意事项
在具体书写离子方程式时,尤其要注意哪些物质可以改写成离子形式,哪些物质不能写成离子形式。
1.强酸的酸式盐,其酸式酸根在溶液中还会电离,应改写成离子符号。如:“HSO4-”可写成“H+”与“SO42-”。如硫酸氢钠与碳酸氢钠溶液反应:
H HCO3-=H2O CO2↑
2.多元弱酸酸式盐的酸式酸根在离子方程式中不能拆开写。如:NaH2PO4和NaOH溶液的反应。
H2PO4- OH-=HPO2-4 H2O
H2PO4- 2OH-=PO3-4 2H2O
3. 磷酸等弱酸在溶液中以分子形式存在,必须保留分子式,HCO3-、HS-、HSO3-、HPO42-等多元弱酸的酸式酸根都不能分开写。如:
磷酸钠与足量稀H2SO4混合
PO43-+3H =H3PO4
碳酸钡与二氧化碳、水的反应
BaCO3 CO2 H2O=Ba2 +2HCO-3
NaH2PO4和NaOH溶液反应
H2PO4-+OH-=HPO42-+H2O
H2PO4-+2OH-=PO43-+2H2O
4.不在溶液中进行的离子反应,不能改写离子方程式。
如固体NH4Cl和Ca(OH)2的反应:
2NH4Cl(固) Ca(OH)2(固)=2NH3↑ CaCl2 2H2O
固体NaCl和浓H2SO4的反应:
2NaCl(固)+H2SO4(浓)=Na2SO4+2HCl↑
5.单质、氧化物在离子方程式中一律写成化学式。如:
SO2与足量NaOH溶液的反应:
SO2 2OH-=SO2-3 H2O
锌与盐酸的反应:
Zn+2H =Zn2 +H2↑
6.没有自由移动的离子参加的反应,不能改写离子方程式,如:有浓硫酸参加的反应,浓硫酸应写化学式。
碳和浓硫酸在加热时的反应
C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
7.当生成物是易溶于水的气体时,要特别注意反应条件,如:
NaOH溶液和NH4Cl溶液的反应。
(1)当浓度不大,又不加热时,离子方程式为:
OH-+NH4 =NH3·H2O
(2)当浓度很大,且又加热时,离子方程式为:
OH-+NH4 =NH3↑+H2O
8.对于微溶物处理方式有三种情况
⑴ 在生成物中的微溶物,当生成沉淀时保留化学式,如:
Na2SO4溶液中加入AgNO3溶液有沉淀生成
2Ag +SO42-=Ag2SO4↓
⑵ 当反应物里的微溶物为稀溶液时,应改写为离子形式,如:
将CO2通入澄清石灰水中
CO2+Ca2 +2OH=CaCO3↓+H2O
澄清石灰水中滴入Na2CO3溶液
Ca2 +CO32-=CaCO3↓
⑶ 反应物里的微溶物为浓溶液,浊液或固态时,改写时保留分子式,如:
向石灰乳中加Na2CO3溶液
Ca(OH)2+CO32-=CaCO3↓+2OH-
向固体Ca(OH)2加入稀盐酸
Ca(OH)2+2H =Ca2 +2H2O
9. 多元酸、碱发生反应时,应注意反应物之间量的关系,如磷酸和Ba(OH)2溶液的反应,依反应物之间的量,其反应有下列几种情况:
⑴ n(H3PO4):n(Ba(OH)2)≥2:1时,
H3PO4+OH-=H2PO-4+H2O
⑵ n(H3PO4):n(Ba(OH)2)=1:1时,
H3PO4+Ba2 +2OH-=BaHPO4↓+2H2O
⑶ n(H3PO4):n(Ba(OH)2)≤2:3时,
2H3PO4+3Ba2 +6OH-=Ba3(PO4)2↓+6H2O
因此,在具体改写时一定要注意用量,若未告诉用量,一般按足量,完全反应改写。
10.离子间能发生相互促进水解反应的,应按双水解反应写离子方程式,如:
硫酸铝与碳酸氢钠溶液
Al3 +3HCO3-=Al(OH)3↓+3CO2↑
硫化钠与硫酸铝溶液混合
3S2-+2Al3 +6H2O=2Al(OH)3↓+3H2S↑
11.要考虑阴、阳离子的配比关系,不能随意对离子或离子系数进行约简,只有当方程式两边各物质前的系数含有公约数的可以约简。如:
Ba(OH)2+2HCl=BaCl2+2H2O
写成离子形式为:
2H++2OH-=2H2O,
所以“2”可以去掉,
离子方程式为H++OH-=H2O。
只在部分物质的系数有公约数则不能去掉。例如:
Ba(OH)2溶液与H2SO4反应:
Ba(OH)2+H2SO4=BaSO4↓+2H2O
其离子方程式为:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
不能写成:
Ba2 SO42-=BaSO4↓,
H OH-=H2O,
或 Ba2 +OH-+H++SO42-=BaSO4↓+H2O
12.要注意实验操作时的顺序。各反应物加入的顺序以及加入的量的多少不同发生不同的离子反应。如
(1)NaOH溶液与AlCl3溶液之间的反应:
若将少量NaOH溶液滴入AlCl3中:
Al3 3OH-=Al(OH)3↓
若将少量AlCl3溶液滴入NaOH中:
Al3 4OH-=AlO-2 2H2O
(2)NaOH溶液与Ca(HCO3)2溶液之间的反应:
Ca(HCO3)2溶液中加入少量NaOH溶液:
Ca2 +OH-+HCO3-=CaCO3↓+H2O
Ca(HCO3)2溶液中加入过量NaOH溶液:
Ca2 +2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
(3)Na2CO3溶液与稀盐酸溶液之间的反应:
Na2CO3溶液中滴加稀盐酸:
CO32-+H =HCO3-
HCO3-+H =CO32-
稀盐酸中滴加Na2CO3溶液:
CO32-+2H =CO2+H2O
13.当反应中可能有多种沉淀生成时,要比较它们的溶解性大小,反应一般向生成溶解度更小的物质的方向进行。如Mg(HCO3)2溶液与足量Ca(OH)2溶液混合时,Mg(OH)2的溶解度远小于MgCO3,所以,其离子方程式为:2Ca2 2HCO-3 4OH- Mg2 =2CaCO3↓ Mg(OH)2↓ 2H2O
14. 具有强氧化性的微粒与强还原性的微粒相遇时,要首先考虑发生氧化还原反应,
如:H2S通入足量FeCl3溶液中
H2S+2Fe3 =2Fe2 +S↓+2H
15. 要注意几个特殊问题:
⑴ 离子反应不但可以发生在离子与离子间,也可以发生在离子与原子、离子与分子之间。如:
Fe+2H+=Fe2++H2↑,
C12+2I-=2Cl-+I2。
⑵ 有些反应从离子方程式看,好像没有离子参加,但实际上却是离子反应。如:
2Na+2H2O=2Na++2OH-+H2↑
实质是钠与水电离出的H+反应,因为水是难电离的,要保留化学式。
⑶ 相同物质之间的化学反应,在一种条件下是离子反应,在另一种条件下就不一定是离子反应,如:
HCl(aq)+NH3(aq)=NH4C1(aq)离子反应
HCl(g)+NH3(g)=NH4Cl(s)分子反应
⑷ 就算同一个离子方程式也可以表示不同的化学反应事实,例如:
H++OH-=H2O.
这一个离子方程式就可以表示强酸与强碱反应的化学反应。
HNO3+NaOH=NaNO3+H2O
⑸ 氨水作为反应物写NH3·H2O;作为生成物,若有加热条件或浓度很大时,可写NH3(标↑号),若是稀溶液且不加热时,可写NH3·H2O。
此外,还应注意反应是否能发生,若反应不能发生,当然也就无离子方程式可言。同时,要注意反应生成物是否正确,如果反应生成物不正确,写出来的离子方程式肯定是错误的。
四、掌握离子方程式正误的检查方法
对写好的离子方程式,应做如下几个方面的检查:
㈠ 离子方程式正误的“四查”
1.查符号。即检查各物质的化学式是否正确,是否将难溶的或难电离的物质写成化学式,所用的状态符号是否正确等。
2.查数目。即检查离子方程式两边元素的原子、离子总数是否相等。
3.查电荷。即检查离子方程式两边离子的电荷数是否相等。
4.查是否符合事实。例如将Fe溶于稀硫酸中错写成:2Fe 6H =2Fe3 3H2↑。粗看此离子方程式和方面都对,但它违背了实验事实,正确的写法应为:Fe 2H =Fe2 H2↑
㈡ 离子方程式正误判断“五看”:
1. 看物质的存在形式和产物是否正确;不能违背反应原理。
如Fe与硝酸反应不生成H2。
2. 看“=”、“↑”、“↓”(盐类水解产生的沉淀,不写“↓”,气体不写“↑”,但双水解要写)用的是否恰当;
⑴ 一般离子的水解反应用“可逆符号”,不注明“↑”或“↓”。
⑵ 两离子水解相互促进生成沉淀或气体时用“=”,注明“↑”或“↓”。
3. 看反应前后是否遵循两守恒(原子守恒和电荷守恒);
如FeCl2与Cl2反应不能写成
Fe2++Cl2 =Fe3++2Cl-(电荷不守恒)
4. 看是否符合题设条件及要求。如“过量”“少量”“等物质的量”“适量”“任意量”以及“滴加顺序”等对反应的影响;
5. 看是否漏掉了某些反应
如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SO42-生成BaSO4沉淀,也不能漏掉Cu2+与OH-生成Cu(OH)2沉淀。