硫酸可以说是最重要的无机含氧酸,其产量是衡量一个国家化工工业发展水平的标志。可见硫酸的重要性。
硫酸的物理性质:无色油状液体,密度大于水,任意比溶于水,熔沸点较高,常温不挥发。有较强的吸水性。

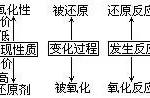
硫酸的化学性质:脱水性、强酸性、强氧化性。和硝酸一样,在常温下,可以使铁铝钝化。在加热的条件下可以和碳或铜发生反应。如果把浓硫酸划到纸上,划痕会很快地变黄,然后变黑。如果把浓硫酸加到蔗糖中,会迅速变黑并膨胀为疏松多孔的黑面包形状,这就是著名的黑面包实验。
正式应为硫酸的这些性质,硫酸成了我们认识的最具*伤力的酸。所以硫酸根据《危险化学品安全管理条例》和《易制毒化学品管理条例》,被公安部门管制。
但这并不妨碍硫酸的广泛用途。硫酸在工业上的用途及其广泛,可以用于制造化肥、药物、炸药、颜料、洗涤剂、蓄电池等,还可以用于净化石油,金属冶炼以及燃料等工业,甚至在有机反应中用作脱水剂、磺化剂以及催化剂等。

人类最早发现硫酸的记载是在中国唐高宗时(公元650-683年),炼丹家孤刚子在其所著的《黄帝九鼎神丹经诀》中有所记载——干馏石胆(胆矾)可以获得硫酸。
后来在公元8世纪阿拉伯炼丹家贾比尔通过干馏硫酸亚铁晶体得到硫酸。但硫酸的大规模生产,开始于18世纪。
17世纪初,德国化学家格劳伯将硫与硝酸钾混合蒸汽加热制出硫酸。在1736年伦敦药剂师Joshua Ward改良此方法,开始大规模生产硫酸。但这个不是很有名气的药剂师J·W老师,用此法制备出来的硫酸浓度只能到65%。
由于浓度较低,逐渐不能满足需要。后经法国的盖-吕萨克盖老师等人的改良,使硫酸的浓度飙升到了78%。

时光如白驹过隙,转眼到了1831年,英国的一个制蜡商人,叫什么,我想不起来了。这个老师兼老板,发明了接触法制硫酸。该方法的出现,使硫酸的价格直接触底,不知道当时有没有炒硫酸期货的,如果有,一部分人要赔个底儿朝天了。接触法制硫酸一直用到了今天,这个制蜡老师,还是很厉害的。这是要前无古人后无来者的节奏。
人们在享受硫酸工业以及应用带来的红利的同时,也受到了硫酸带来的副方面的影响——酸雨,酸雨的产生,对建筑、金属、植被、作物等有不可忽略的影响,进而影响人类的生存。还好,人们及时注意到了。
你还知道硫酸的哪些知识,可以一起讨论!