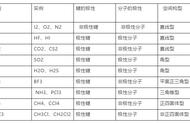
3.3化学键 分子间力 高分子材料
3.3.1化学键
化学键:原子结合态中相邻原子间较强烈的相互作用。(注意三个加粗关键词)
键能:原子间作用力的大小,125kJ-900kJ/mol(记住这个数字,下面还要和它比较)
化学键分类:离子键/共价键(金属键和配位键是特殊共价键)
分类依据:电负性之差大于1.7为离子键,小于1.7为共价键(部分教材说是1.8~2.0,离子键和共价键之间没有明显的分界线,部分物质属于二者过渡)(电负性的知识见3.2元素周期律)
3.3.1.1离子键
当活泼金属和活泼非金属元素的原子互相接近时,前者失去电子形成正离子,后者得到电子形成负离子。正、负离子通过静电相互作用结合成离子型化合物。这种由正、负离子之间的静电引力形成的化学键叫做离子键。
离子键的本质:正、负离子之间的静电引力
离子键的特征有:
1) 由正、负离子形成,本质是静电引力。
2) 电负性差值越大,形成的键的离子性越强
3) 没有方向性、没有饱和性。
离子晶体不是电和热的良好导体(不要和离子晶体的溶液搞混了)。
原因:没有游离的电子,电子受原子核强力束缚。在固态下,离子本身也很难移动。溶于水后形溶液,就是良好的导体了。
离子键强弱的影响因素(也是熔点的影响因素):
1)正负离子的电荷
2)离子半径
3)离子的电子层结构
(这部分知识在2.2中的固体那一节有讲述)
3.3.1.2共价键
共价键是两个原子共用成键电子对形成的,成键电子对可以由两个原子共同提供,也可以由一个原子单独提供(后者习惯上称为配位键)。
所用的理论:
电子配对理论;杂化轨道理论;分子轨道理论;价键理论;价层电子对互斥理论;(这些理论在工科化学里一般不做要求)
共价键特点:
饱和性:形成共价键时键合原子双方各提供自旋方式相反的未成对价电子。1个原子能形成共价单键的最大数目等于其未配对电子的数目。共价键的两个电子的自旋量子数ms必须一个是 1/2,另一个是-1/2.
方向性:共价键是原子轨道重叠形成的,而原子轨道的角度分布上同号重叠(对称性匹配)才是有效重叠;并且原子轨道重叠时要满足最大重叠条件,轨道重叠越多,共价键也越牢固。因此,共价键具有方向性。

希腊字母打不出来,只好截图
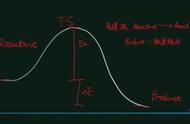
共价键中,电子云重叠部分越大,代表着键能越大,化合键越难被打开,也就是化合键越稳定。

两种共价键的特点
共价键是最常见的化学键,世界上超过1亿种化合物,其中共价化合物占90%以上。
如果说某化合物有共价键,首先是第一类共价键,如果含有双键或者叁键,那么除了一个第一类键,剩余的就是第二类键。第一类共价键有且只有一个。
3.3.1.3分子的空间构型和杂化轨道理论
分子的空间构型:共价型分子中的各原子在空间排列所构成的几何形状叫做分子的空间构型。
为了从理论上说明各种分子不同的空间构型,1931年Pauling等提出化学键的杂化轨道理论。(这已经是本章第三次介绍到这个人的成果了)
杂化:在形成多原子分子的过程中,若干不同类型能量相近的原子轨道混杂成同样数目的能量完全相同的新原子轨道,这种重新组合的过程称为杂化。
杂化轨道:杂化所形成的新原子轨道称为杂化轨道。
杂化轨道理论的要点:
① 在形成分子时,中心原子中能级相近的若干不同类型的原子轨道可以“混合”*(杂化),形成一组能级相同成键能力更强的杂化轨道。(必须能级相近)
② n个原子轨道杂化后,形成n个杂化轨道,即数目相等。(数目不变)
③ 杂化轨道与其它原子成键时,共用电子对间要采取排斥力最小的位置,以使分子系统的能量最低,分子最稳定。(最稳定原则)
杂化轨道的类型:
按杂化轨道的成份分:参与杂化的原子轨道可以是s轨道、p轨道或d轨道。
sp杂化轨道:由1个s轨道和1个p轨道混杂而成, s成份和p成份各占1/2。,比如CH4
sp2杂化轨道:由1个s轨道和2个p轨道混杂而成, s成份和p成份各占1/3和2/3,比如CH2=CH2
sp3杂化轨道:由1个s轨道和3个p轨道混杂而成, s成份和p成份各占1/4和3/4,比如乙炔
等性杂化和不等性杂化
所有杂化轨道均等价时,称为等性杂化,否则为不等性杂化。
sp3不等性杂化
若杂化轨道的能量、成分、形状完全相同,称为等性杂化。
分子中,杂化轨道有未参加成键的孤对电子存在,使各杂化轨道的能量、成分不相同,这类杂化称为不等性杂化。
孤对电子所占的轨道叫做非键轨道

NH3是一对未成键的孤对电子和3个N-H共价键杂化而成的