01-药品的保存
按物理性质,对于易挥发、易潮解、易吸水的试剂进行密封保存。
按化学性质,对于酸性试剂、碱性试剂注意选用合适的瓶塞;对于易分解的试剂需用棕色试剂瓶避光保存,而对于易被氧化的试剂等要注意采用油封或水封等方法保存。
对于化学危险品,需要在试剂瓶上贴上相应的标识,如腐蚀品、爆炸品等标识。
02-药品的取用原则
实验室取用药品时,遵循安全("三不"原则)、节约、保纯原则。取用药品时,注意根据
药品状态和所需量的不同选用合适的仪器。
03-实验仪器的精确度
常用计量仪器的精确度
托盘天平0.1g
量筒 0.1mL
滴定管0.01mL
广泛pH试纸1(整数)
04-实验安全操作
直接加热仪器:试管、蒸发皿、坩埚、燃烧匙
间接加热仪器:烧杯、烧瓶、锥形瓶
实验安全"六防":防倒吸、防中毒、防着火、
防暴沸、防爆炸、防污染。
05-突发事故的处理
突发事故的处理措施:
酒精灯起火——沙子或湿抹布盖灭
钠、钾起火——沙子盖灭
温度计水银球破裂——硫粉覆盖
重金属盐中毒——饮用大量牛奶、豆浆,并及时送医
酸性(碱性)试剂沾到皮肤上——大量水冲洗,再涂抹碳酸氢钠溶液(硼酸)
试剂溅到眼睛里——大量水清洗,边洗边眨眼睛
液溴、苯酚沾到皮肤上——酒精擦洗
01-混合物:固-固分离
固-固分离法:
重结晶
升华
磁铁吸附
浮选
02-混合物:固-液分离
固-液分离法:
固体不溶于液体——过溏
固体溶于液体——蒸发
过源操作:一贴二低三靠
蒸发操作:余热加热、不断搅拌
03-混合物:液-液分离
液-液分离法
互溶、沸点相差大——燃馏
互溶、沸点相差小——分馏
互不相溶——分液
蒸馏操作:温度计与支管口齐平;冷凝水下
进上出
分液操作:下层液体下放,上层液体上倒
04-萃取剂的选择:
萃取剂的选取:
1.萃取剂与原溶液不反应、不相溶;
2.萃取剂与原溶液密度差异大;
3.溶质在萃取剂和原溶剂中的溶解度差异大。
05-混合物:气-气分离法:
气-气分离法:
洗气
液化
06-混合物:化学分离法
化学分离法:
加入试剂法、热分解法、电解法、离子交换
法
加入试剂法:
溶解法、洗气法、沉淀法、氧化还原法、络
合法
01-物理性质鉴别物质
利用物理性质鉴别物质:
根据颜色、气味、溶解性、焰色反应等物理性质
不同进行鉴别。
02-气体的检验
试纸法:
氨气——湿润红色石蕊试纸
氯气——湿润淀粉碰化钾试纸
试液法:
二氧化碳——澄清石灰水
二氧化硫——品红溶液
点燃法:
看现象、产物
03-离子检验-沉淀法
沉淀法:
硫酸根离子——盐酸、氨化钒溶液
氯离子——硝酸、硝酸银溶液
04-离子检验-气体法
气体法:
铵根离子——生成氨气
碳酸根离子——生成二氧化硐
亚硫酸根离子——生成二氧化硫
05-离子检验-气体法
显色法:
氢离子——加指示剂显色
氢氧根离子——加排示剂显色
铁离子——加硫氰化钾显血红色;加苯酚显紫色
01-物质的量的概述
物质的量:表示含有一定数目微观粒子的集合体
符号:n
单位:mol
适用对象:微观粒子
表示方法:数字 mol 微粒名称/化学式
02-阿伏加德罗常数
阿伏加德罗常数:1mol代何物质所含有的粒子个数
符号:NA
数值:6.02x10^23
转化关系:n=N/NA
03-摩尔质量的概述
摩尔质量:单位物质的量物质具有的质量
符号:M
单位:g/mol
数值:以g/mol为单位时,等于相对分子质量
转化关系:n=m/M
04-气体摩尔体积概述
气体摩尔体积:一定温度和压强下,单位物质的
量气体所占的体积
符号:Vm
单位:L/mol
影响因素:温度、压强
标况下:Vm=22.4L/mol
转化关系:n=V/Vm
标况(0℃、101kKPa):Vm=22.4L/mol
常温常压(25℃、101KPa):Vm>22.4L/mol
非标况:Vm也可能为22.4L/mol
标准状况下,SO3呈固态,CCl4呈液态
06-阿伏加德罗定律
阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同数目的粒子
表达式:同T、P,V1/V2=N1/N2
推论:同T、P,V1/V2=n1/n2
同T、P,p1/p2=M1/M2
物质的量浓度概述
物质的量浓度:单位体积溶液里所含溶质的物质的量
符号:c
单位:mo/ML
转化关系:n=cV
02-物质的量浓度计算
n=N/NA=m/M=V/Vm=cV(aq)
03-物质的量浓度与溶液稀释
c=1000pω/M
C(浓)v(浓)= C(稀)v(稀)
04-容量瓶的使用
容量瓶的使用:
规格:100mL、250mL、500mL、1000mL
使用前检漏
定容时平视刻度线
移液前冷却至标示温度
不可加热、不可溶解、不可稀释、不可作反应容器、不可长期贮存溶液
05-配制一定量浓度的溶液
配制溶液的步骤:计算、称量、溶解、移液、洗涤、摇匀、定容、振荡
06-配制溶液中的误差分析
误差分析:c=n/V=m/MV
从质量引起的误差、体积引起的误差两方面考虑。
01-按状态进行物质的分类
分散系:一种(或多种)物质分散在另一种(或多种)物质中所得到的体系;前者被分散的物
质,称为分散质,后者起容纳分散质的作用,称为分散剂。
按分散质和分散剂的状态分类,共分为9类分散系。
02-按粒子大小进行物质的分类
按分散质粒子大小分类:溶液<1nm 胶体1~100nm浊液>100nm
溶液:均一、稳定,能通过源纸和半透膜
胶体:均一、介稳,能遥过滤纸,但不能通过半透膜
浊液:不均一、不稳定,不能通过渡纸和半透膜
03-胶体的性质之丁达尔效应
丁达尔效应:光束通过胶体时,由于胶体粒子对光的散射,形成一条光亨的"通路"。
应用:区分溶液和胶体。
04-胶体的性质之电泳与聚沉
电泳:在电场的作用下,胶体粒子在分散剂中做定向移动的现象。
布朗运动:胶体粒子的不间断、无规则运动的现象。
聚沉:向胶体中加入少量的电解质溶液时,阴离子或阳离子中和了胶体粒子所带的电荷,使胶体粒子聚集成较大的颗粒,从而形成沉淀从分散剂里析出。
聚沉的方法:加入电解质溶液、加入相反电荷的胶体、加热或搅拌。
05-氢氧化铁胶体的制备
制备氢氧化铁胶体的步骤:蒸馍水煮沸,滴入饱和氯化铁溶液,继续煮沸至红褐色,停止加热。
01-电解质概述
电解质:在水溶液里或蒸融状态下能够导电的化合物。
非电解质:在水溶液里和熔融状态下都不导电的化合物。
02-电解质与导电关系
电离:电解质在水溶液或熔融状态下,产生自由移动离子的过程。
03-电解质种类
电解质包括酸、碱、盐、活泼金属氧化物、水
05-强弱电解质、非电解质
强电解质:在水溶液中,能够完全电离的化合物,包括强酸、强碱、盐。
弱电解质:在水溶液中,只能部分电离的化合物,包括弱酸、弱碱、水。
非电解质:在水溶液中和熔融状态下,均不能电离的化合物,包括非金展氧化物、部分有机物。
06-电解质强弱与溶解度
电解质强弱表示电解质电离程度大小,与溶解度、导电能力没有直接关系。
例如:氢氧化钙、硫酸钡溶解度很低,但是强电解质,氨水、醋酸溶解度很大,但是弱电解质。
01-书写电离方程式
电离方程式书写原则:
左边——化学式,右边——离子符号
以事实为依据,遵守质量守恒和电荷守恒
强电解质写等号,弱电解质写可逆符号
多元弱酸分步电离,以第一步电离为主;多元弱碱一步电离
02-如何书写离子方程式
离子方程式:用实际参加反应的离子符号来表示反应的式子。
书写四步骤:写、拆、消、查
03-关于书写离子方程式中不拆分的物质
四大微溶物:氧氧化钙、硫酸钙、硫酸银、碳酸镁
作反应物时,可溶,拆
作产物时,不可溶,不拆
看状态,浑浊不拆,澄清拆
04-离子方程式正误判断
看整体:是否符合反应事实、漏写离子、两端守恒
看局部:离子配比、化学式拆分、反应物用量是否合理
01-复分解反应引起的共存问题
离子因发生复分解反应不能共存的情况:生成难溶物或微溶物、生成气体、生成弱电解质
02-酸式酸根离子的共存问题
弱酸酸式酸根离子在强酸性溶液和强碱性溶液中均不能稳定存在。
例如:碳酸氢根、亚硫酸氢根、硫氢根、二磷酸氢根等。
03-氧化还原反应引起的共存问题
常见的氧化性离子:次氯酸根离子、高锰酸根离子、铁离子、硝酸根离子、重铬酸根离子等
常见的还原性离子:亚铁离子、碘离子、溶离子、硫离子、亚硫酸根离子等
04-双水解反应引起的共存问题
因相互促进的水解反应而不能共存的离子:
铝离子与碳酸根、碳酸氢根、硫离子、硫氢根、次氯酸根、偏铝酸根;
铁离子与碳酸根、碳酸氢根、偏铝酸根、次氯酸根;
铵根离子与偏铝酸根、硅酸根;
特例:常温下都能水解,但能共存的离子:铵根离子与醋酸根、碳酸根,镁离子与碳酸氢根能共存。
05络合反应引起的共存问题
因发生络合反应不能共存的离子:银离子与氨水,铜离子与氨水,铁离子与硫氰酸根离子
06附加隐含条件的共存问题
附加隐含条件主要包括:颜色、酸碱性
有颜色的离子:铜离子(蓝色)、铁离子(棕黄色)、亚铁离子(浅绿色)、高锰酸根离子(紫红色)等
01-氧化还原反应的判别
氧化还原反应的判别:看是否有化合价升降、看是否有电子转移或偏移
02-氧化剂、还原剂的判别
氧化剂:得电子、化合价降低、发生还原反应、对应产物是还原产物
还原剂:失电子、化合价升高、发生氧化反应、对应产物是氧化产物
03-双线桥法、单线桥法
双线桥法:画线桥、标"得失"、写电子转移黯
单线桥法:画线桥、写电子转移数
04-歧化反应与归中反应
歧化反应:反应中某个元素的化合价既有上升又有下降的氧化还原反应。
归中反应:两个或多个含有不同价态某元素的反应物发生氧化还原反应,元素价态向中间靠拢。
05-氧化性、还原性强弱判断
氧化性:化学反应中元素得到电子的能力。
还原性:化学反应中元素失去电子的能力。
判断方法:
1.利用金属/非金属活动性顺序
2.同一反应中,"剂">"产物"
3.看产物价态
4.看反应条件
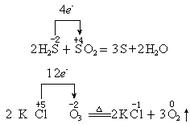
01-氧化还原反应的四大规律
氧化还原反应的四大规律:守恒规律、价态规律、先后规律、不交叉规律
02-氧化还原反应的基本配平法
氧化还原反应的基本配平法:
标——标化合价
列——列电子转移数
定——定计量数
配——配方程式
查——查质量、电荷、得失电子守恒
03-归中反应、歧化反应的配平
归中反应、歧化反应的配平:一标、二列、三定、四配、五查;
归中反应符合只靠近不交叉规律。
04-氧化还原反应的高阶配平法
氧化还原反应的高阶配平法:平均配平法、零价配平法、整体配平法
05-氧化还原反应的计算
氧化还原反应的计算步骤:找出剂和产物、判断化合价升降情况、列关系式
氧化还原反应的计算依据:守恒规律——得失电子守恒
01-钠与水溶液的反应
钠与水溶液的反应:先与水反应,生成氡气。
特殊:钠与酸溶液的反应,先与酸中的氡离子反应生成氢气。
02-氧化钠、过氧化钠的性质比较
氧化钠:碱性氧化物,与水、二氧化碳、盐酸反应不放出氧气
过氧化钠:过氧化物,与水、二氧化碳、盐酸反应放出氧气
03-过氧化钠与二氧化碳、水蒸气的反应
过氧化钠与二氧化碳、水蒸气的反应:
先后顺序:先与二氧化碳反应,再与水蒸气反应。
定量关系:1mol过氧化钠反应转移Imol电子、气体体积减少1/2、1mol过氧化钠与二氧化碳反应固体增重28g,与水蒸气反应固体增重2g。
04-碳酸钠与碳酸氧钠
碳酸钠与碳酸氧钠:
溶解性、碱性、热稳定性:前者强于后者
二者鉴别方法,加热、加酸、加钙盐或钡盐、加酚酞
除杂方法:除去固体碟酸钠中的碳酸氢钠——加热
除去碳酸氢钠溶液中的碳酸钠——通入足量二氧化碳
05-碳酸钠、碳酸氢钠与盐酸反应
碳酸钠与盐酸反应,先生成碳酸氢钠,后放出二氧化碳。
碳酸氢钠与盐酸反应,直接放出二氧化碳。
01-铝与盐酸、氧化钠溶液反应
铝与盐酸、铝与氢氧化钠溶液反应均放出氢气。
02-氧化铝、氢氧化铝
氧化铝——两性氧化物,能与强酸、强碱反应
氢氧化铝——两性氢氧化物,能与强酸、强碱反应
03-铝三角
铝盐、偏铝酸盐、氢氧化铣三者可以相互转化。
04-铝盐与强碱、偏铝酸盐与强酸
铝盐与强碱反应时,滴加顺序不同,现象不同;
偏铝酸盐与强酸反应时,滴加顺序不同,现象不同。
01-铁的化学性质
铁与非金属单质(如氧气、氯气、硫)反应
铁与水蒸气高温反应生成四氧化三铁
铁与非氧化性酸(如盐酸)反应放出氢气,与遇
氧化性酸(如渊硝酸)反应放出一氧化氨,与浓硝酸、浓硫酸常温下发生钝化
铁与铜离子、铁离子反应
02-铁的几种氧化物概述
铁的几种氧化物:氧化亚铁、氧化铁、四氧化三铁
03-铁的两种氢氧化物的性质
氢氧化铁:红褐色难溶固体,受热分解生成氧化铁
氢氧化亚铁:白色难溶固体,易被氧气氧化成氢氧化铁
04-铁、亚铁离子、铁离子之间可以相互转化
05-亚铁离子与铁离子的鉴别方法
亚铁离子与铁离子的鉴别方法:观察颜色、加硫氰化钾、加氢氧化钠、加高锰酸钾、加碘化钾
01镁的化学性质
单质镁的化学性质:
镁与非氧化性酸(如盐酸)反应放出氢气
镁与非金属单质(如氧气、氨气)等反应
镁与二氧化碳反应生成氧化镁和碳
02-氧化镁、氢氧化镁的化学性质
氧化镁:白色难溶固体,碱性氧化物,溶于酸,与酸反应。
氢氧化镁:白色难溶固体,与酸反应,受热发生分解。
03-铜的化学性质:
铜的化学性质:
铜与非金属单质反应,与氧气、氮气反应生成二价铜,与硫反应生成一价铜。
铜与非氧化性酸不反应,与强氧化性酸(如浓疏酸、浓稀硝酸)反应放出气体。
铜与铁盐溶液反应生成二价铁盐和二价铜盐。
04-铜的几种化合物概述
氧化铜:黑色难溶固体,与酸反应。
氧化亚铜:砖红色难溶固体,与酸反应生成铜盐和铜。
氡氧化铜:蓝色难溶固体,与酸反应,受热发生分解。
碱式碳酸铜:振色固体,受热发生分解,生成三种氧化物。
05-几种重要的合金概述
合金:由两种或两种以上的金屠(或金属与非金属)熔合在一起而形成的具有金属特性的物质,一般,合金硬度比组分金属大,熔点比组分金属低。
常见合金:铁合金(含碳量不同的钢、不锈钢)、铜合金(青铜、黄铜、白铜)
06-金屠活动性顺序表
金屠活动性顺序表:钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金
01-碳、硅概述
金刚石:熔点高、硬度大、天然存在最硬的物质
晶佐硅:熔点高、硬度大、半导体材料
硅的化学性质;加热时,与氧气反应;与氢氟酸反应;与强碱反应放出氢气
02-二氧化碳、二氧化硅的化学性质
二氧化碳、二氧化硅——酸性氧化物,兵有酸性
氧化物的通性,可以与碱性氧化物、碱反应
二氧化硅的特殊性:不能与水反应,可以和氢氟酸反应生成四氰化硅
二氧化硅的主要用途:制作光导纤维
03-碳酸、硅酸概述
碳酸、硅酸——弱酸,与碱反应
硅酸:酸性比碳酸弱,"强酸制弱酸"原理制备硅酸
硅酸的用途:常用作食品和药品的干燥剂
04-硅酸盐制品概述
硅酸钠:水溶液俗称水玻璃,耐高温,常用于制备硅酸
三种常见的硅酸盐制品:陶瓷、水泥、普通玻璃
05-硅的工业制取
硅的工业制取:以石英砂为原料,经过焦炭高温还原,得到粗硅,粗硅在高温下与氯气反应获得四氧化碳,最后经过氢气的高温还原,制得高纯硅。
01-氯气与金属、非金属的反应
氯气与钠反应:点燃,产生白烟,产物氯化钠
氯气与铁反应:点燃,产生棕褐色烟,产物氧化铁
氯气与铜反应,点燃,产生棕黄色烟,产物氰化铜
氯气与氢气反应:点燃,火焰呈苔白色,产生白雾,产物氧化氡
02-氯水概述
氯水:氯气的水溶液。
氯水的性质:强氧化性、酸性、漂白性。
次氯酸:比碳酸弱的弱酸,具有强氧化性,能*菌、漂白,不稳定,见光易分解。
03-漂白液、漂白粉、漂白精
漂白液、漂白粉、漂白精:由氯气通入相应的碱溶液中获得
漂白液:有效成分为次氯酸钠
漂白粉:有效成分为次氯酸钙
漂白精:主要成分为次氧酸钙
04-氯气的实验室制备
氯气的实验室制备:二氧化锤与浓盐酸加热或高锰酸钾与浓盐酸常温反应制备。
05-卤素离子的检验
卤素离子的检验:加入稀硝酸酸化的硝酸银溶液。
01-硫概述
硫的物理性质:淡黄色昀体,不溶于水,易溶于二硫化碳。
硫的化学性质:与非金属单质(如氢气、氧气)等反应、与金属单质反应,通常生成低价态硫化物。
02-二氧化硫概述
二氧化硫的物理性质:无色有刺激性气味气体,易溶于水。
二氧化硫的化学性质:具有酸性氧化物的通性,具有氧化性(如与硫化氢反应生成硫单质),具有还原性(如使酸性高锰酸钾溶液、溴水褪色)。
03-二氧化硫的漂白性
二氧化硫的漂白性:使品红溶液褪色。
检验二氧化硫的方法:遥入品红溶液中,溶液视色,加热后,红色恢复。
04-三氧化硫概述
三氧化硫的物理性质:标况下,呈固态。
三氧化硫的化学性质:具有酸性氧化物的通性,可与水、碱、碱性氧化物反应。
05-硫酸概述
稀硫酸:具有酸的通性。
浓硫酸:无色粘稠液体,有吸水性、脱水性、腐蚀性。
浓硫酸的强氧化性:与铜、碳加热反应放出二氧化硫。
01-氨气概述
氨气的物理性质:无色有刺激性气味气体,极易溶于水。
氨气的化学性质:碱性气体,水溶液呈碱性;与酸反应生成铵盐。
02-氨气的实验室制备
铵盐的性质:受热易分解,与碱反应放出氨气。
氨气的实验制备:以氯化铰与氢氧化钙为原料,加热制备氨气;浓氨水与生石灰作月制备氨气;
加热氨水制氨气。
03-一氧化氮、二氧化氮概述
一氧化氮:无色气体,难溶于水,与氧气反应生成二氧化氨。
二氧化氮:红棕色气体,可溶于水,与水反应生成硝酸和一氧化氨。
04-硝酸概述
硝酸:具有酸的通性,具有强氧化性。
硝酸的强氧化性:常温下,铜与浓硝酸反应放出二氧化氮,与稔硝酸反应放出一氧化氮。
01-原子的构成
原子由原子核和核外电子构成,原子核由质子和中子构成,其中质子决定元素种类,核外电子影响元素的化学性质。
粒子间的数量关系:质量数(A)=质子数(Z) 中子数(N)
02-元素、核素、同位素
元素:具有相同核电荷数(即质子数)的同一类原子的总称。
核素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
03-核外电子排布
原子核外电子由内向外分层排布,离核越近,能量越低。电子层由内向外依次为:K L M N O P Q
核外电子排布的一般规律:
每层最多容纳的电子数为2n2个
最外层电子数不超过8个
次外层电子数不超过18个
倒数第三层电子数不超过32个
K层为最外层、次外层时不超过2个
01-元素周期表结构
元素周期表结果:按周期,分3个短周期,4个长周期;按族,分7个主族,7个副族,1个第V族,1个0族。
序差:同周期相邻主族元素序数差为1(IIA和第三A之间除外);同主族相邻元素,过渡元素左边序差等于上方元素所在周期的元炙种类数,过渡元素右边的序差等于下方元素所在周期的元素种类数。
02-由原子序数确定元素在周期表中的位置
由原子序数确定元素在周期表中的位置:
以0族元素原子序数为基准鞅元素的纵列数=该原子序数-0族元沐原子序
数(相近且大)
某元素的纵列数=18 该原子序数-0族元素原子
序数(相近且小)
01-碱金属的化学性质
碱金属的化学性质:
相似性:都能与氧气、水等反应
递变性:单质还原性:弱到强
反应剧烈程度:弱到强
与02反应产物越来越复杂
对应碱的碱性:弱到强
02-由原子序数确定元素在周期表中的位置
由原子序数确定元素在周期表中的位置:
以0族元素原子序数为基准
某元素的纵列数=该原子序数-0族元素原子序数(相近且大)
某元素的纵列数=18 该原子序数-0族元素原子序数(相近且小)
02-碱金属的物理性质
碱金属的物理性质:均是银白色金属铯除外),单质的熔、沸点逐渐减小。
01-卤素单质的物理性质
卤素单质的物理性质:
相似性:有色,熔沸点较低。
递变性:颜色逐淅加深,熔沸点逐渐升高。
02-卤素单质的化学性质
卤素单质的化学性质:
相似性:都能与水、氢气、金属反应。
递变性:氧化性逐渐减弱,与氢气反应由易到
难。
特殊性:F元素没有正价态,与水反应生成氢氟酸同时放出氧气。
01-元素周期律
元素周期律:同周期主族元素从左到右,原子半
径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
02-粒子半径大小比较
粒子半径大小比较:
同周期从左到右,原子半径逐渐减小;同主族从上到下,原子半径逐渐增大。
同电子层结构的离子,核电荷数越多,离子半径越小。
同元素的原子或离子,核外电子数越多,半径越大。
03-金属性、非金属性强弱比较
金属性、非金属性强弱比较:
同周期从左到右,金属性逐渐减弱,非金属性逐渐增强;
同主族从上到下,金属性逐淀增强,非金属性逐淅减弱。
04-同周期、同主族元素性质
主要考查同周期、同主族元素性质递变规律、位、构、性"三者的关系、元素周期表和
元素周期律的应用。
01-离子键、离子化合物
离子键:阴阳离子间的静电作用力
离子化合物:含有离子键的化合物
常见的离子化合物:强碱(如氢氧化钠),活泼
金属氧化物、过氧化物,绝大多数盐(如氯化铵、硫酸钙)
02-离子化合物的电子式书写
原子的电子式:在元素符号上下左右标出最外层电子。
复杂阴、阳离子的电子式:标明电子,要用[ ]括起来,并在[ ]右上角标明" ""-"及电荷数。
离子化合物的电子式把阴阳离子的电子式按比例组合。
01-共价键、共价化合物
共价键:原子间通过共用电子对所形成的相互作用,包括极性共价键和非极性共价键。
共价物:只含有共价键的物质,包括共价单质和共价化合物。
02-共价物质的电子式书写
共价物质的电子式:把原子的电子式通过共用电子对按比例组合,使各原子达到稳定结构。
共价物质的结主式:一对共用电子对用"—"。
03-化合物类型的判断
离子化合物与共价化合物的区别:
离子化合物一定含离子键,可能含共价键,共价化合物只含共价键。
01-化学键
化学键包括:离子键、共价键、金属键。
化学反应的实质:旧键的断裂,新键的形成。
02-分子间作用力、氢键
分子间作用力:存在于分子之间,比化学键弱,影响物质的熔沸点。
氢键:主要存在于N—H、O—H、F—H,比化学键弱,但比分子间作用力稍强,使物质熔沸点显著增加。
03-几种粒子间作用力的对比
几种粒子间作用力的对比:
离子键存在于离子间,共价键存在于原子间,金属键存在于金属中,分子间作用力存在于分子之间,氡键存在于N、O、F的氢化物中。
01-化学键与化学反应能量变化的关系
化学反应与能量变化的关系:
化学反应常伴随能量变化,但有能量变化的不一定是化学反应。
E反与E生的关系:
E反>E生,反应放能;E反<E生,反应吸能。
02-化学能与热能的相互关系
放热反应:E反>E生
吸热反应:E反<E生
放热反应:反应物键能<生成物键能
吸热反应:反应物键能>生成物键能
03-化学键在反应热计算
反应热△Q=Q(吸)-Q(放)△Q<0,为放热反
应,△Q>0,为吸热反应。
Q(吸):所有参与反应的物质断键所吸收的能量总和。
Q(放):所有生成物形成新键所释放的能量总和。
01-原电池的结构
原电池是一种能够将化学能转变为电能的装置。
原电池的构成条件;
①两种活动性不同的金属(或一种金属与一种非金属导体)作电极
②有电解质溶液;
③形成闭合回路;
④自发的氧化还原反应。
01-原电池原理

02-正负极电极判断方法
正负极电极判断方法:可根据电极材料、电子得失、电流电子流向、溶波中离子移动等判断。
03-原电池原理的应用
原电池原理的主要应用:比较金屠的活动性强弱、加快氧化还原反应速率、设计原电池。
01-干电池(一次性电池)

02-铅蓄电池(充电电池)

03-氢氧燃料电池