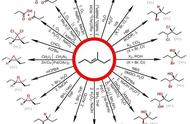
副标题:光激发硝基芳烃用于烯烃氧化裂解
烯烃是一类来自石油和生物质的大宗化学品,在化学工业中常被用来制备高附加值的合成中间体。其中,臭氧解反应(ozonolysis)是将烯烃转化为高附加值含氧中间体的常用方法(图1a),该过程往往需要专用设备将分子氧(O2)转化为高活性臭氧(O3),再与烯烃进行[1,3]-偶极环加成生成高能量的1,2,3-臭氧化物A,接着经环分解生成羰基氧化物B和羰基化合物C,随后B和C*生成1,2,4-臭氧化物D。最后,在不同条件下处理B和D便可生成相应的醛/酮以及羧酸或醇。然而,由于臭氧存在毒性(5 ppm时致命)、爆炸性和氧化性等问题,严重地阻碍了臭氧化还原分解在精细化工和高通量筛选平台等方面的应用。近年来,科学家开发了一种替代策略,即利用高价重金属氧化物(MO4, M = metal)来促进烯烃的氧化,但是该方法会产生各种氧化程度的混合物并导致微量金属污染,从而阻碍在制药、化工生产等众多领域的应用。尽管还开发了一些策略(如光催化)来实现氧化裂解,但是仅限于活化烯烃。这些现实的问题使得开发一种温和、绿色且通用的烯烃氧化方法就成了迫切的需要。
近日,德国亚琛工业大学Daniele Leonori与英国曼彻斯特大学Marco Simonetti等研究者通过光激发硝基芳烃并与烯烃发生自由基[3 2]环加成,成功地合成了1,2,3-臭氧化物A的替代物——安全、稳定的“N-doped”臭氧化物E,在温和的水解条件下便可生成相应的羰基产物。具体反应机理如下(图1b):首先光激发单重态的硝基芳烃发生系间窜越(ISC)生成长寿命的三重态自由基 (T1) *N,再与烯烃进行自由基[3 2]环加成反应生成双自由基F,进而发生系间窜越生成关键的中间体——1,3,2-二噁唑烷E(即“N-doped”臭氧化物),最后经C-C键裂解便可形成所需的羰基产物(C/C')。相关成果发表于Nature 上。

图1. 光激发的硝基芳烃代替臭氧。图片来源:Nature
首先,作者选择2,2'-金刚烷烯(1)为模板底物(图2a),将其与不同电性的硝基芳烃(N)置于光催化条件下进行环加成反应以获得稳定的1,3,2-二噁唑烷中间体(E),Hammett图显示硝基芳烃的电性与表观速率常数(kobs)之间存在很强的线性关系(ρ=0.82),这意味着可通过调节硝基芳烃中吸电子基团的位置来调控激发态的亲电性。为此,作者评估了未活化烯烃(2)的反应性(图2b),结果显示市售可得的硝基芳烃(N1)能有效地与2进行反应并生成相应的“N-doped”臭氧化物(E1),E1具有很好的安全性和稳定性。随后,作者尝试将中间体E转化为相应的羰基化合物C和C'(图2c),此时有两种反应途径:1)臭氧解型环还原裂解产生C和G(path a);2)不同的环还原裂解模式直接生成C/C'和氮宾I(path b)。为了证实这一过程,作者选择邻位3,5-二甲基吡唑基(作为氮宾形成的探针)取代的中间体E2进行反应,结果显示在CH3CN-H2O中能以定量的收率生成酮3和N-芳基羟胺H1,而在CH3CN中则生成3和4(由G1和CH3CN经[1,3]-偶极环加成得到),这表明中间体E是通过path a生成C和G,随后水解为C'和H。另外,E1在CH3CN-H218O中的分解实验证明了E1的环裂解产生6和更稳定的偶极子G(图2d),而E3在CH3CN-H2O中分解时以71%的收率获得7,但是加入福尔马林后则能以95%的收率获得7,这些结果证实了E的分解途径非常高效,H和C/C'之间的缩合平衡以及后续的副反应会使醛类产物的纯化具有挑战性。为此,作者开发了两种一锅法来实现醛产物的纯化(图2e),即添加K2HPO4和尿素(将H转化为K)或N-苯基马来酰亚胺(将J1转化为L)来去除H。

图2. 机理研究。图片来源:Nature
在最优条件下,作者根据烯烃结构的不同,采用不同种类的硝基芳烃(N1-N7)来考察底物范围。如图3所示,不同基团(如氰基、羰基、卤素、氨基、硝基、羟基、环氧化物、硫醚、膦酸酯、硼酸酯等)取代的链状末端烯烃(2、8-32)、双取代内烯烃(33-39)、不同尺寸的环烯烃(40、41)、偕二取代烯烃(42)、三取代烯烃(43)、二烯烃(44)以及不同基团取代的苯乙烯(45-50)甚至二苯乙烯(51、52)均能兼容该反应,以中等至较好的收率得到相应的产物。另外,该方法还能实现天然产物和药物分子的后期修饰,例如:异植物醇(53)、香紫苏醇(54)、阿利苯多(55)、石竹烯氧化物(56)、孟鲁司特钠(57)、植物醇(58)、(-)-α-雪松烯(59)、曲普利啶(60)、氯普噻吨(61)、苯芴醇(62)以及(Z)-他莫昔芬(63)。

图3. 底物拓展。图片来源:Nature
*N 的另一个特点是可充当三重态的敏化剂,并在光环加成过程中使烯烃异构化。实际上,未反应的底物63是以Z/E-混合物的形式分离获得的,因此作者尝试通过电子效应的相互作用来实现反应的化学选择性。如图4a所示,作者合成了由相同烷基间隔连接的两种不同烯烃(64-69),并对其与N1、N2、N4和N8的反应效果进行了评估,结果表明该反应的位点选择性取决于硝基芳烃和两种烯烃的电性,即富电子的硝基芳烃和其中一个双键含有更富电子基团的烯烃进行反应时选择性会增加,这意味着当底物难以控制选择性时,可以调控硝基芳烃的电性以提高反应的选择性。值得注意的是,N8和N4可以在单取代烯烃的存在下选择性地裂解三取代烯烃(64)和苯乙烯(65),同时对内烯烃vs.端烯烃(66)、三烷基取代的烯烃vs.二烷基取代的烯烃(67)、苯乙烯vs.内烯烃(68)以及两个高度活化的烯烃(69)均具有较好的选择性。此外,N1也能使端烯炔底物(70)具有完全的选择性,并以82%的收率获得相应产物。

图4. 烯烃的选择性氧化。图片来源:Nature
最后,为了证明电子、空间和极性效应能控制反应的选择性,作者评估了几种含有多个C-Cπ 位点的复杂分子的反应性(图4b)。因烯烃电性的原因,含有烯烃和α,β-不饱和羰基的(-)-香芹酮(71)和夫西地酸(72)选择性地在烯烃端进行反应,而含有多个不饱和类固醇的依西美坦(73)和醋酸甲地孕酮(74)则是在较富电子的烯烃端发生氧化裂解。另外,Lynestrol(75)凸显了炔烃存在下烯烃的选择性氧化,而醋酸烯丙雌醇(76)、芳樟醇(77)和trans-石竹烯(78)则是在三取代烯烃处进行选择性裂解。有趣的是,烯丙基位含有OAc基团(具有弱诱导效应)的三取代烯烃(如乙酸香叶酯(79)、乙酸紫苏酯(80))优先裂解其它C-Cπ 位点,并且添加HFIP(与OAc形成氢键)后选择性更高,环苯扎林(81)也观察到类似的效应。值得注意的是,空间位阻也可以控制红没药醇乙酸酯(82)和瓦伦烯(83)的裂解选择性,并在空间位阻较小的无环烯烃处进行反应。
总结
本文提出光激发硝基芳烃代替臭氧与烯烃发生反应的策略,成功地合成了1,2,3-臭氧化物的替代物——“N-doped”臭氧化物,并在温和的水解条件下生成了相应的羰基化产物。该方法不仅条件温和、官能团耐受性好,而且对药物分子以及复杂生物活性分子的后期修饰也具有很好的效果。此外,该方法通过调控硝基芳烃上的电性、空间和极性效应,可实现含有多个烯烃底物的选择性氧化裂解。
Photoexcited Nitroarenes for the Oxidative Cleavage of Alkenes
Alessandro Ruffoni, Charlotte Hampton, Marco Simonetti, Daniele Leonori
Nature, 2022, DOI: 10.1038/s41586-022-05211-0