免疫组化全称为免疫组织化学染色(IHC),是通过抗原和抗体的特异性结合,使标记抗体的显色剂 (通常是酶,也有荧光素、金属离子、同位素) 显色,来对细胞内的抗原(多肽和蛋白质)进行定位、定性及定量的研究。
免疫组化的技术优势是能将细胞形态学改变与功能和代谢的变化结合起来,直接在组织切片上定位目标蛋白和多肽物质的存在,并可精确到亚细胞结构水平,敏感性和特异性均较高,已成为肿瘤病理检查中使用最广泛的一种技术。
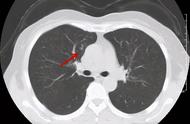
以肺癌的病理诊断来说,需要先从患者身上取样制作标本,样本可以是患者胸、腹水中抽取的细胞(即细胞学病理),也可以是手术切除或者穿刺取得的小块组织(即组织学病理,优选)。
然后依次进行形态学(HE染色)、分子病理学(免疫组化染色)、分子分型的诊断,这三个诊断层面从宏观到微观逐级深入。

对大多数肺癌来说,通过对HE染色标本的形态学观察,即可区分出非小细胞肺癌和小细胞肺癌。
但如果有些标本的形态学复杂难辨,或者要判断非小细胞肺癌到底是腺癌还是鳞癌,或者想知道肿瘤的良恶性程度如何,以及肺部的肿瘤到底是原发性还是转移性的等等,想要明确这些问题,就必须通过免疫组化检查。
在免疫组化报告中,通常用( )或者“阳性”表示检测到该指标(即蛋白或多肽),使用(-)或者“阴性”表示未检测到该指标。这些指标就是通过大量研究总结出来的、最能表征肺癌类型的免疫组化标志物。
▋▏肺癌常用的免疫组化标志物
CSCO(中国临床肿瘤学会)指南推荐的标志物:
肺腺癌:TTF-1、Napsin A
肺鳞癌:CK5/6,P40或P63
小细胞癌:CD56、Syno、CgA、INSM1、TTF-1、CK、Ki-67(其中INSM1是2023版指南最新增加的标志物)

★01
TTF-1(甲状腺转录因子-1)在75%-85%的肺腺癌中表达,不过它与分化程度正相关,分化差的腺癌中可能不表达,在鳞癌中则基本不表达。
★02
Napsin A(新天冬氨酸蛋白酶A)在70%-90%的肺腺癌中表达,与TTF-1结合是检测肺腺癌最好的标志物组合。同时,在神经内分泌瘤中不表达。
★03
CK5/6(基底细胞角蛋白)在75%-100%的肺鳞癌中表达,且与分化程度无关,不过由于它在上皮样间皮瘤中也会高表达,所以,需要与p63表达结合才能支持鳞状细胞癌的诊断。
★04
p63/p40,p40是p63 蛋白的一个亚型,它们都位于细胞核内,超过90%的肺鳞癌会强烈表达,腺癌则基本不表达。
如果出现TTF-1和p63同时阳性的情况,在形态学不具有鳞状特征的前提下,首选分类为腺癌,因为p63可以在腺癌中表达而TTF-1几乎不在鳞癌中弥漫性表达(>50%的肿瘤细胞表达)。
如果出现TTF-1和p63同时阴性的情况,则仍怀疑腺癌,因为TTF-1在差分化腺癌中缺失表达的现象较常见,而p63在鳞癌中的表达非常稳定。
★05
CgA Syno CD56是神经内分泌瘤的经典标志物,神经内分泌瘤包括类癌、大细胞癌和小细胞癌。
CgA全称嗜铬粒蛋白A是一种大分泌颗粒位于基质中的蛋白,特异性最强。
CD56全称神经细胞黏附分子,主要分布于神经外胚层来源细胞。
Syno全称突触素,存在于神经内分泌细胞中,非神经内分泌瘤和肉瘤中不表达Syno,是目前普遍认为的诊断神经内分泌肿瘤敏感且特异性强的标记物。Syno在小细胞肺癌中表达较多,在肺鳞癌表达极少,因此可用于小细胞癌与肺鳞癌的鉴别诊断。
★06
2023版CSCO指南里新增了INSM1(胰岛素瘤相关蛋白1)作为小细胞肺癌的免疫组化标志物,多项研究证明了INSM1在肺神经内分泌瘤具有优秀的敏感性和特异性。
而且INSM1是细胞核染色,上述3个经典的标志物是细胞质或细胞膜染色,对组织损伤较重、坏死明显的标本,INSM1核染色更明显,采用INSM1更有优势。
★07
Ki-67(增殖指数)有助于鉴别不同类型的神经内分泌瘤。
典型类癌的Ki-67指数通常≤5%,属于低级别,非典型类癌为5%~20%,属于中级别;而小细胞肺癌的数值通常可能为70-100%,属于高级别,增殖活跃。
★08
DSG3(桥粒芯蛋白3)近年来也广泛应用于肺腺癌和鳞癌的鉴别诊断,85%-90%的肺鳞癌表达DSG3,肺腺癌几乎不表达(<2%)。
DSG3 NapsinA的组合能区别85%以上的肺腺癌和鳞癌。DSG3 CK5/6的组合可以诊断92.6%的鳞癌。
★09
CK(细胞角蛋白)是一个大家族。CK5/6是肺鳞癌最常用的免疫标志物, 表达于75%-100%的肺鳞癌,并且其表达与鳞癌的分化、分级无关。2%-33%的肺腺癌也可表达CK5/6,但常呈局灶性低水平表达。CK5/6需要结合p63才能支持对鳞癌的诊断。
CK7几乎在100%的肺腺癌表达,特别是在鉴别肺原发性腺癌和转移性结直肠腺癌时,CK7常作为首选的抗体组合成员。但CK7的特异性较低,30%-60%的肺鳞癌也会表达,因此,在诊断肺腺癌时,需结合其他特异度高的标志物如TTF-1、Napsin A。
Cam5.2(包括CK8和CK18)也是常用的低分子量角蛋白,几乎100%表达于肺腺癌,但因特异性较低,几乎所有类型的腺癌均有表达,所以在肺腺癌诊断价值有限。
★10
SP-A、SP-B(肺泡表面糖蛋白)仅表达于约50%的肺腺癌,表达的组织学谱系较窄,主要表达于分化程度较高的腺癌,在差分化肺腺癌常常表达缺失,临床诊断的价值比较有限。

▋▏提示肺癌恶性程度的标志物
上文所提的Ki-67指标(细胞增殖指数),它不仅能辅助鉴别肺癌类型,还能提示肿瘤的良恶性。因为Ki-67是一种在细胞核中发现的蛋白,只在细胞分裂期才表达,所以与细胞的分裂和增殖关系密切。
在正常组织中,绝大部分细胞都处于静止期(G0期),不表达Ki-67。如果检测的Ki-67数值越高,则说明标本中处于增殖分裂的细胞比例就越高,这些细胞将快速生长,侵袭性越强,恶性程度也越高。很多研究都证明,Ki-67决定了大部分肿瘤的复发、转移,对临床的指导意义超过了肿瘤的组织学分型。
依据Ki-67蛋白的特性,它还可用于评估化疗是否对患者有效。化疗药物的作用机理就是破坏生长期细胞(G1、S、G2 和 M 期)的各类生物活动,对静止期细胞作用微弱。所以,Ki-67数值高的肿瘤,往往化疗效果会更好,至于哪个范围算高哪个范围算低,则与具体肿瘤相关,不能简单一概而论。
▋▏指导肺癌治疗的标志物
近年来,伴随着诊断技术的发展以及肺癌新药的快速上市,用来指导肺癌治疗的标志物也更新得很快。
在最新发布的2023版CSCO肺癌诊疗指南里,对于不可手术的III期、IV期非鳞非小细胞肺癌患者,I级推荐里除了检测EGFR、ALK、ROS1、RET、MET14跳跃突变外,新增了对BRAF V600突变、NTRK融合突变的检测。II级推荐还建议进行KRAS、HER-2突变、MET扩增等基因变异检测。
今年3月美国发布的NCCN指南对标志物的检测也有修改,将PD-L1检测提前到第一位,排在了EGFR、ALK之前,而且此前仅建议II-IIIA期患者检测PD-L1,这次的新版本里去掉了分期限制,建议所有患者都做,足见NCCN专家组对PD-L1新辅助免疫治疗的重视。我国指南目前还是建议不可手术的III期、IV期非小细胞肺癌患者检测PD-L1,不过未来的趋势肯定是向NCCN看齐。
想要精准检测这些指导治疗的标志物,需要多种检测方法的交叉验证,除了基于蛋白质层面的免疫组化外,二代基因测序也是目前常用的方法。NGS不但能利用组织活检,还能利用外周血来检测循环游离肿瘤细胞ctDNA,这种技术对于身体状况不支持组织活检的晚期患者可能会更加友好。
还应注意的是,如果患者出现耐药,则应考虑对进展性病变再次进行组织活检,因为组织学转化也是靶向治疗的一种耐药机制,对奥希替尼一线治疗的患者来说,每16例耐药中就可能有1例是因为发生了向小细胞肺癌的转化,这种情况如果不进行组织活检是很难发现的。
本文我们将这些治疗标志物和对应药物汇总成图表,后续的文章还会就靶向治疗的主题进行详细说明,免疫治疗的主题则可以参考我们此前的文章。