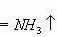⑴质的方面:表示该反应的反应物(或原料)和生成物(或产品)
⑵量的方面:表示该反应中各物质的质量关系。
2.基本书写依据和格式:a计算依据:依据化学方程式中各物质的质量比(即各物质的相对分子质量之比)来进行计算;
b计算步骤:
① 解,设未知量
② 写出反应化学方程式
③ 写出有关物质的相对分子质量和已知量、未知量
④ 列比例式,求解
⑤ 简明作答
3.常见题型⑴根据反应物(或生成物)的质量计算反应物(或生成物)中某种物质的相对分子质量
⑵有关纯净物的化学方程式的计算,即:
1.已知反应物(或生成物)的质量,求生成物(或反应物)的质量;
2.已知一种反应物(或生成物)的质量,求另一种反应物(或生成物)的质量。
⑶含杂质(杂质不参加反应)的计算
化学方程式反映的是纯净物间的质量关系,若遇到不纯物时,应先把不纯物的质量换算成纯净物质量。
⑷计算参加反应的物质间的质量比
4.例题精讲例1. 16.8g铁在氧气中完全燃烧,需要消耗 g氧气,同时生成 g四氧化三铁 。
解析:解:设消耗氧气的质量为x,生成四氧化三铁的质量为y。

答:反应中消耗6.4g氧气,生成23.2g四氧化三铁。
答案:6.4g,23.2g
例2. 已知4.8g金属M与足量的稀硫酸反应,生成MSO4和0.4g氢气,则M的相对原子质量为 。
解析:解:设M的相对原子质量为x。

答:M的相对原子质量为24。
答案: 24
例3. 煅烧含碳酸钙80%的石灰石100t,生成二氧化碳多少吨?若石灰石中的杂质全部进入生石灰中,可以得到这样的生石灰多少吨?

答案: 32.5t,64.8t
例4.20g的高锰酸钾在试管中加热一段时间后,再称剩余固体的质量为19.8g,则生成氧气的质量是( )
A. 19.8g
B. 0.2g
C. 2.0g
D. 不能确定
答案:B
例5.在实验室里用氢气还原氧化铜制取铜,若制取0.64g铜需要氧化铜的质量是多少?
答案:8g
例6.加热31.6g高锰酸钾,当得到3.2g氧气时,剩余的固体为( )
A.K2MnO4和MnO2
B.KMnO4和MnO2
C.KMnO4和K2MnO4
D.KMnO4、K2MnO4和MnO2
答案: A
例7.在2A B =2C反应中,已知B的相对分子质量为32,C的相对分子质量为40,则A的相对分子质量为( )
A. 24
B. 48
C. 4
D. 8
答案: A
例8.4.6g某有机物完全燃烧时需消耗9.6g氧气,生成8.8g二氧化碳和5.4gH2O,该有机物中( )
A.只含碳、氢两种元素
B.只含碳元素
C.含有碳、氢、氧三种元素
D.可能含氧
答案: C
例9.将干燥、纯净的氯酸钾与二氧化锰混合,取31g混合物装入试管中加热,待充分反应后,将剩余固体物质冷却后称得其质量为21.4g,试回答:
(1)根据 定律,反应后可生成氧气 g;
(2)21.4g剩余固体中含有 和 两种物质;
(3)求原混合物中氯酸钾的质量。
答案:质量守恒定律 9.6g 氯化钾、二氧化锰 24.5g
例10. 用一氧化碳冶炼含杂质4%的生铁500t,需纯度为80%的赤铁矿石多少吨?(假设冶炼过程中铁没有损失,而且杂质中不含铁)
答案:857.1t

下一篇文章 化学方程式大全