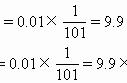(3)工业上合成甲醇的另一种方法为:
CO(g) 2H2(g)

CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
【答案】⑴ -250KJ/mol
⑵ 正 CH4 4O2-8e-=CO2 2H2O
⑶① AB ② 3(mol/L)2 ③ 升高温度 增大压强(或增大CO的浓度)④ b>c>a