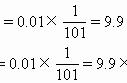高考微专题:化学平衡常数计算题型归纳
题型一、Kc的计算
例1、T1温度时,在容积为2 L的恒容密闭容器中发生反应:2NO(g)+O2(g)
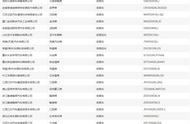
2NO2(g)ΔH<0。实验测得不同时刻测得容器中n(NO)、n(O2)如表:
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
n(NO)/mol |
0.20 |
0.10 |
0.08 |
0.07 |
0.06 |
0.06 |
n(O2)/mol |
0.10 |
0.05 |
0.04 |
0.035 |
0.03 |
0.03 |
T1温度时,化学平衡常数K=______。 (结果保留3位有效数字)
解析:利用“三段式法”进行计算:

则根据化学平衡常数的定义可得K=≈3.63。
题型二、Kp的计算
例2、Deacon发明将氯化氢直接转化为氯气:4HCl+O2 2Cl2+2H2O。在恒容密闭容器中,按照进料浓度比c(HCl)∶c(O2)分别等于7∶1、4∶1、1∶1时,HCl平衡转化率随温度变化的关系如图所示。

500 ℃时以曲线Ⅱ所示进料比反应达到平衡时,容器内总压强为pMPa,则反应平衡常数Kp=____________(以分压表示,分压=总压×物质的量分数)。
解析:500 ℃时曲线Ⅱ中HCl平衡转化率为50%,进料浓度比c(HCl)∶c(O2)=n(HCl)∶n(O2)=4∶1,利用“三段式法”计算:

平衡时容器内总压强为pMPa,则p(HCl)=2p/4.5MPa,p(O2)=0.5p/4.5(MPa,p(Cl2)=p(H2O)=p/4.5MPa,则反应平衡常数Kp=[(p/4.5MPa)2×(p/4.5MPa)2]/[(2p/4.5)MPa)4×0.5p/4.5MPa]=9/16p(MPa)-1
例3、


答案:①大于 温度升高,容器体积不变,总压强增大;反应CH3OH(g) ‘CO(g)+2H2(g)为吸热反应,温度升高,平衡正向移动,气体总物质的量增大,气体总压强增大
②43.9
题型三、Kx的计算
例4、已知:N2O4(g)2NO2(g)ΔH>0。298 K时,将一定量N2O4气体充入恒容的密闭容器中发生反应。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为25%,反应N2O4(g) 2NO2(g)的平衡常数Kx=________[对于气相反应,用某组分B的物质的量分数x(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kx]。
解析:N2O4(g)2NO2(g),N2O4气体的平衡转化率为25%,设起始时N2O4的物质的量为x,则平衡时剩余的N2O4的物质的量为0.75x,生成的NO2的物质的量为0.5x,混合气体平衡总压强为p,则NO2分压为p×0.5x+0.75x(0.5x)=0.4p;N2O4分压为p×0.5x+0.75x(0.75x)=0.6p;反应N2O4(g)2NO2(g)的平衡常数Kx=0.42/0.6=4/15。
关注:头条@高中化学教书匠